Définition
Définition : Titrage par colorimétrie
Un titrage par colorimétrie est basé sur un changement de couleur de la solution aqueuse quand l'équivalence est atteinte. Cette méthode peut être utilisée pour des titrages qui font appel à des réactions acido-basique, d'oxydoréduction ou de complexation. Souvent, avant et après l'équivalence, les espèces présentes dans la solution étudiées ne sont pas colorées. Il est donc nécessaire d'ajouter dans le système une molécule ou un ion que l'on appelle indicateur coloré et qui changera de couleur au passage de l'équivalence.
Dans la suite de ce cours on se limitera aux titrages par colorimétrie basés sur une réaction acido-basique.
Définition : Indicateur coloré pour une réaction de titrage acido-basique
Dans le cas d'une réaction de titrage acido-basique on ajoutera dans le bécher qui contient la solution à titrer une molécule ou un ion que l'on appelle indicateur coloré car il change de couleur en fonction du pH. L'indicateur coloré appartient à couple acido-basique dans lequel l'acide et la base présentent des couleurs différentes. Comme cela a été expliqué dans le chapitre qui traite des diagrammes de prédominance pour un couple acido-basique, la prédominance de l'acide ou de la base conjuguée dépendra du
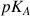 du couple de l'indicateur coloré. Si le pH de la solution est supérieur au
du couple de l'indicateur coloré. Si le pH de la solution est supérieur au
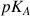 du couple de l'indicateur coloré alors la forme basique sera prédominante et donnera sa couleur à la solution. Si le pH est inférieur au
du couple de l'indicateur coloré alors la forme basique sera prédominante et donnera sa couleur à la solution. Si le pH est inférieur au
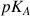 la solution aura la couleur de la forme acide de l'indicateur coloré.
la solution aura la couleur de la forme acide de l'indicateur coloré.
Définition : Zone de virage d'un indicateur coloré
La zone de virage d'un indicateur coloré est la zone de pH pour laquelle la couleur prise par la solution est un mélange des couleurs de la teinte acide et de la teinte basique.
Exemple :
Pour le couple acido-basique de l'indicateur coloré phénolphtaléine,
 . La forme acide est incolore et la forme basique est rose. Si on met cet indicateur coloré dans une solution d'eau distillée celle-ci restera incolore car son pH est égal ou inférieur à 7 (
. La forme acide est incolore et la forme basique est rose. Si on met cet indicateur coloré dans une solution d'eau distillée celle-ci restera incolore car son pH est égal ou inférieur à 7 (
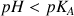 donc la forme acide du couple acido-basique de la phénolphtaléine est prédominant). Si on verse une solution de soude (on augmente donc le pH de l'eau distillée de départ) on verra apparaître une couleur rose pour un pH aux alentours de 8,5 (la quantité de la forme basique augmente et deviendra majoritaire pour pH > 9,2). Pour cet indicateur coloré la zone de virage (voir tableau ci-dessous) est comprise dans l'intervalle 8,2 < pH <10.
donc la forme acide du couple acido-basique de la phénolphtaléine est prédominant). Si on verse une solution de soude (on augmente donc le pH de l'eau distillée de départ) on verra apparaître une couleur rose pour un pH aux alentours de 8,5 (la quantité de la forme basique augmente et deviendra majoritaire pour pH > 9,2). Pour cet indicateur coloré la zone de virage (voir tableau ci-dessous) est comprise dans l'intervalle 8,2 < pH <10.
Choix de l'indicateur coloré
On a vu que le changement de couleur de la solution qui contient l'indicateur coloré dépend de la valeur du
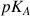 du couple acido-basique auquel il appartient. Cependant ce changement de couleur commencera à être observé avant que le pH n'atteigne la valeur du
du couple acido-basique auquel il appartient. Cependant ce changement de couleur commencera à être observé avant que le pH n'atteigne la valeur du
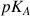 du couple de l'indicateur coloré car les quantités des espèces acides et basiques deviendront de plus en plus proches et on observera donc un mélange de couleur. Le changement de couleur ne sera net qu'une fois que la forme acide ou basique sera très majoritaire. Dans le tableau des indicateurs colorés qui est donné ci-dessous on a indiqué la zone de virage de couleur ainsi que le
du couple de l'indicateur coloré car les quantités des espèces acides et basiques deviendront de plus en plus proches et on observera donc un mélange de couleur. Le changement de couleur ne sera net qu'une fois que la forme acide ou basique sera très majoritaire. Dans le tableau des indicateurs colorés qui est donné ci-dessous on a indiqué la zone de virage de couleur ainsi que le
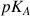 du couple acido-basique associé à l'indicateur coloré (la valeur du
du couple acido-basique associé à l'indicateur coloré (la valeur du
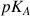 est bien entendu comprise dans cet intervalle).
est bien entendu comprise dans cet intervalle).
Afin de déterminer le volume d'équivalence d'un titrage acido-basique il est nécessaire que la zone de virage de l'indicateur coloré sélectionné contienne le pH à l'équivalence
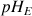 . Le volume versé de réactif titrant au changement de couleur donc à l'équivalence sera noté
. Le volume versé de réactif titrant au changement de couleur donc à l'équivalence sera noté
 .
.
Cette méthode de détermination du volume de réactif titrant versé à l'équivalence sera précise si le saut de pH autour de l'équivalence est brusque. Cela entraînera en effet un changement net de la couleur de la solution.







