Spectrophotométrie
Définition : Absorbance A
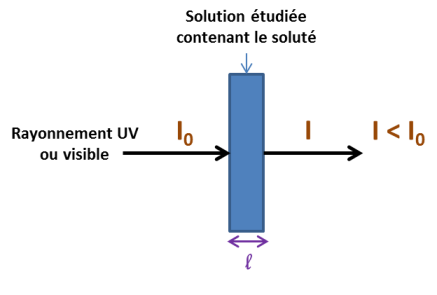
L'absorbance A d'une solution est calculée à partir de l'intensité du rayonnement
 , émis par la lampe du spectrophotomètre et de l'intensité I observée après le passage du rayonnement à travers la solution (voir schéma).
, émis par la lampe du spectrophotomètre et de l'intensité I observée après le passage du rayonnement à travers la solution (voir schéma).
On définit
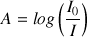 . C'est une grandeur sans unité donnée directement par le spectrophotomètre.
. C'est une grandeur sans unité donnée directement par le spectrophotomètre.
Définition : Loi de Beer-Lambert
L'absorbance A d'une espèce en solution est directement reliée à sa concentration C dans la solution selon la loi de Beer-Lambert :

Attention :
Cette relation n'est valable que pour des solutions de faible concentration. Il sera donc souvent nécessaire de diluer la solution à étudier si elle est trop concentrée. On remontera à la concentration initiale ensuite en utilisant le facteur de dilution.
Attention :
Le solvant (l'eau en solution aqueuse) et la cuve qui contient la solution mesurée absorbent également une partie du faisceau lumineux. Cet effet, même si il est généralement faible, ne doit pas être négligé. Afin de s'affranchir de cette contribution on mesure l'absorbance d'une cuve remplie du solvant (de l'eau distillée dans notre cas) et on retranche cette valeur à la valeur mesurée pour la cuve remplie de la solution à étudier. Cette correction est prévue par les fabricants de spectromètres UV-visible. Deux approches sont alors possibles. Dans la première on fait une mesure de la cuve remplie d'eau et on indique à l'appareil que la valeur de l'absorbance est égale à 0 et ensuite on mesure la solution étudiée. La deuxième fait appel à un spectromètre équipé d'un double faisceau : on mesure simultanément la cuve remplie de solvant et la cuve remplie de solution à étudier et le logiciel de l'appareil retranche la première contribution à la seconde.
Complément : La constante k
D'après le cours du premier semestre on a
 avec :
avec :
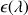 coefficient d'absorption molaire qui dépend de la longueur d'onde du rayonnement utilisé (dans le domaine du visible
coefficient d'absorption molaire qui dépend de la longueur d'onde du rayonnement utilisé (dans le domaine du visible
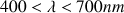 ). Pour le dosage on fixera cette valeur à la longueur d'onde du maximum d'absorption
). Pour le dosage on fixera cette valeur à la longueur d'onde du maximum d'absorption
 de l'espèce chimique étudiée. On devra toujours travailler à longueur d'onde constante.
de l'espèce chimique étudiée. On devra toujours travailler à longueur d'onde constante. est l'épaisseur de solution traversée par le rayonnement (voir schéma ci-dessus)
est l'épaisseur de solution traversée par le rayonnement (voir schéma ci-dessus)
Méthode : Droite d'étalonnage
On doit disposer de solutions étalons qui contiennent l'espèce en solution que l'on veut doser. On mesure l'absorbance A de ces solutions étalons pour une gamme de concentration suffisante pour établir correctement la courbe d'étalonnage qui est d'après la loi de Beer-Lambert une droite si on trace A = f(C), voir figure ci-dessous.
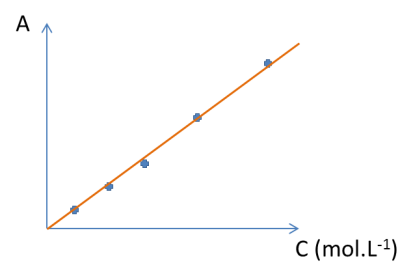
Méthode : Déterminer la concentration de la solution à étudier à partir de la droite d'étalonnage.
On mesure l'absorbance
 de la solution à étudier et on détermine le point de la droite d'étalonnage de même absorbance (
de la solution à étudier et on détermine le point de la droite d'étalonnage de même absorbance (
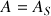 ), voir étape 1 du schéma. L'abscisse de ce point de la droite d'étalonnage est la concentration
), voir étape 1 du schéma. L'abscisse de ce point de la droite d'étalonnage est la concentration
 avec
avec
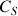 la concentration de la solution analysée (voir étape 2 du schéma).
la concentration de la solution analysée (voir étape 2 du schéma).







