Conductimétrie
Le dosage par conductimétrie, basé sur la loi de Kohlrausch, est adapté dans le cas où l'espèce dosée est un électrolyte (voir connaissances de base) qui se dissocie en ions dans l'eau. La conductivité d'une solution dépend de la concentration, de la nature des ions et de la température.
Définition : Loi de Kohlrausch
La conductivité
 d'une solution qui contient des espèces ioniques est directement reliée à sa concentration C dans la solution par la loi de Kohlrausch :
d'une solution qui contient des espèces ioniques est directement reliée à sa concentration C dans la solution par la loi de Kohlrausch :
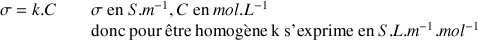
Remarque :
Cette loi correspond à l'expression de la conductivité molaire
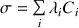 (voir chapitre connaissances de base). Pour simplifier l'utilisation de la relation
(voir chapitre connaissances de base). Pour simplifier l'utilisation de la relation
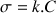 on va garder C en
on va garder C en
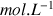 ce qui explique l'unité plus complexe pour k. Dans le chapitre connaissances de base on avait exprimé C en
ce qui explique l'unité plus complexe pour k. Dans le chapitre connaissances de base on avait exprimé C en
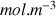 ce qui donnerait comme unité pour k :
ce qui donnerait comme unité pour k :
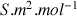 (même unité que celle de la conductivité molaire ionique
(même unité que celle de la conductivité molaire ionique
 ).
).
Attention :
Cette relation n'est valable que pour des solutions de faible concentration. Il sera donc souvent nécessaire de diluer la solution à étudier si elle est trop concentrée. On remontera à la concentration initiale ensuite en utilisant le facteur de dilution.
Attention :
La conductivité mesurée est corrigée de la conductivité de l'eau distillée (qui contient toujours des ions même en faible quantité) afin d'avoir
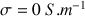 pour
pour

Donc si la conductivité de la solution mesurée est
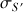 et celle de l'eau distillée
et celle de l'eau distillée
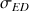 , la conductivité corrigée est
, la conductivité corrigée est
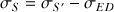 .
.
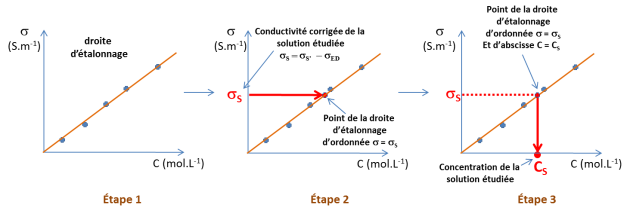
Droite d'étalonnage
On doit disposer de solutions étalons qui contiennent l'espèce en solution que l'on veut doser. On mesure la conductivité corrigée
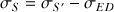 (
(
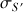 : conductivité de la solution,
: conductivité de la solution,
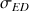 : conductivité de l'eau distillée qui sert de solvant) de ces solutions étalons pour une gamme de concentration suffisante pour établir correctement la courbe d'étalonnage qui est d'après la loi de Kohlrausch une droite si on trace
: conductivité de l'eau distillée qui sert de solvant) de ces solutions étalons pour une gamme de concentration suffisante pour établir correctement la courbe d'étalonnage qui est d'après la loi de Kohlrausch une droite si on trace
 = f(C) (voir étape 1 schéma 3).
= f(C) (voir étape 1 schéma 3).
Déterminer la concentration de la solution à étudier à partir de la droite d'étalonnage.
On mesure la conductivité corrigée
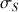 de la solution à étudier et on détermine le point de la droite d'étalonnage de même conductivité (
de la solution à étudier et on détermine le point de la droite d'étalonnage de même conductivité (
 ), voir étape 2 du schéma 3. L'abscisse de ce point de la droite d'étalonnage est la concentration
), voir étape 2 du schéma 3. L'abscisse de ce point de la droite d'étalonnage est la concentration
 avec
avec
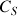 la concentration de la solution analysée (voir étape 3 du schéma).
la concentration de la solution analysée (voir étape 3 du schéma).