Taux d'alcoolémie
(Tiré du site de la sécurité routière)
En France, il est interdit de conduire avec une alcoolémie supérieure à 0,5 g d'alcool par litre de sang (ou 0,25 mg d'alcool par litre d'air expiré). L'alcoolémie est le taux d'alcool présent dans le sang. Elle se mesure en grammes par litre de sang (analyse de sang) ou en milligrammes par litres d'air expiré (éthylotest, éthylomètre).
Données :
• Couples redox : Cr2O72-(aq)/Cr3+(aq)
CH3COOH(aq)/ CH3CH2OH(aq) (acide éthanoïque/éthanol)
• Masse molaire moléculaire de l'éthanol : 46 g.mol-1 .
• Masse molaire moléculaire du bichromate de potassium: 294 g.mol-1 .
• Couleurs des espèces chimiques en présence :
Espèces chimiques | CH3CH2OH | Cr2O72– | Cr3+ | CH3COOH |
|---|---|---|---|---|
Couleur en solution aqueuse | incolore | jaune orangé | vert | incolore |
Question
1) Quelle est la réaction d'oxydoréduction que l'on peut observer entre l'éthanol et les ions Cr2O72- (ions bichromates)?
3 CH3CH2OH(aq) + 2 Cr2O72-(aq) + 16H+(aq) = 3CH3COOH(aq) + 4 Cr3+(aq) + 11 H2O(l)
( Cr2O72-(aq) + 6 e- + 14 H+(aq) = 2 Cr3+(aq) + 7 H2O(l) ) × 2
( CH3CH2OH(aq) + H2O(l) = CH3COOH(aq) + 4 e- + 4 H+(aq) ) × 3
-------------------------------------------------------------------------------
3 CH3CH2OH(aq) + 2 Cr2O72-(aq) + 16H+(aq) ⇌ 3CH3COOH(aq) + 4 Cr3+(aq) + 11 H2O(l)
Question
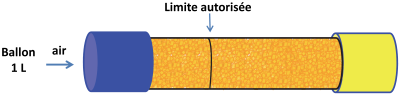
2) Dans un éthylotest on va mettre des cristaux de gel de silice (blancs au départ) imprégnés de bichromate de potassium (jaune orangée) afin de détecter la présence d'alcool dans l'air expiré par un conducteur. Le conducteur doit remplir avec son souffle un ballon de 1 L et le vider dans le tube qui contient ces cristaux (voir figure).
a) A partir de quelle quantité de bichromate de potassium (en gramme) qui a réagi le conducteur est-il en infraction avec la loi ?
b) De quelle couleur deviennent les cristaux jaune-orangée qui ont réagis.
2) a)
Tableau d'avancement
Équation | 3 CH3CH2OH(aq) + 2 Cr2O72-(aq) + 16H+(aq) ⇌ 3CH3COOH(aq) + 4 Cr3+(aq) + 11 H2O(l) | |||||
État initial | n0 | n1 | Excès | 0 | 0 | / |
État intermédiaire | n0 – 3x | n1 – 2x | Excès | 3x | 4x | / |
État final | n0 – 3xmax =0 | n1 – 2xmax = 0 | Excès | 3xmax | 4xmax | / |
Les deux réactifs sont limitants donc n0(CH3CH2OH) – 3xmax = 0 et n1(Cr2O72-) – 2xmax = 0
Calcul de n0(CH3CH2OH)
La limite autorisée dans 1 L d'air expiré est de 0,25 mg de CH3CH2OH (éthanol)
Donc n0(CH3CH2OH) = m0(CH3CH2OH)/M(CH3CH2OH)
A.N. n0(CH3CH2OH) = 0,25.10-3/46 = 5,435.10-6 mol
Calcul de xmax
n0(CH3CH2OH) – 3xmax = 0 donc xmax = n0(CH3CH2OH)/3 = 1,812.10-6 mol
Calcul de la quantité de K2Cr2O7
n(K2Cr2O7) = n1(Cr2O72-)
n1(Cr2O72-) = 2xmax = 3,623.10-6 mol
Donc n (K2Cr2O7) = 3,623.10-6 mol
m(K2Cr2O7) = n (K2Cr2O7)×M(K2Cr2O7)
A.N. m (K2Cr2O7) = 3,623.10-6 × 294 = 1,07 mg
Remarque
on a xmax = n0(CH3CH2OH)/3 et xmax= n1(Cr2O72-)/2
Donc les 2 réactifs sont limitants si n0(CH3CH2OH)/3 = n1(Cr2O72-)/2
Cette égalité correspond au mélange stœchiométrique de CH3CH2OH et Cr2O72-
Question
3) Sur le dessin du tube de l'éthylotest, la marque bleue correspond à la limite maximale autorisée pour le taux d'alcoolémie. Ce tube contient 3,2 mg de bichromate de potassium.
Le taux d'alcoolémie mesuré dans le sang d'un conducteur A est égal à 1,63.10-2 mol/L.
a) Quel est le taux d'alcoolémie équivalent dans l'air expiré en mg/L ?
b) Calculer la quantité de bichromate de potassium nécessaire pour réagir avec la quantité d'alcool contenu dans un ballon de 1L rempli et dans lequel le conducteur A a soufflé.
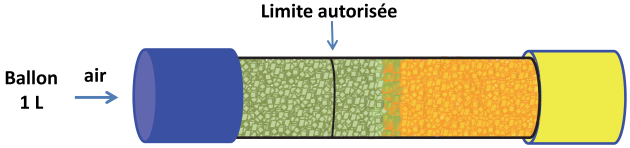
c) Dessiner schématiquement les couleurs que l'on aurait observées dans le tube de la figure si le conducteur avait utilisé cet éthylotest avant de démarrer sa voiture.
3) a)
1,63.10-2 mol/L de CH3CH2OH dans un litre de sang correspond à m(CH3CH2OH) = 1.63.10-2×M(CH3CH2OH) = 1,63.10-2×46 = 0,75 g
Le taux du conducteur est donc de 0,75 g par litre de sang.
D'après le texte introductif, un taux de 0,5 g/L de sang correspond à 0,25 mg/L d'air expiré.
Donc le taux du conducteur est 0,25/0,5×0,75 = 0,375 mg/L (d'air expiré).
3) b)
Donc n(CH3CH2OH expiré) = 0,375.10-3/M(CH3CH2OH) = 0,375.10-3/46 = 8,152.10-6 mol
Pour neutraliser cette quantité d'éthanol il faut n(Cr2O72-)/2 = n(CH3CH2OH)/3 (voir remarque fin de 2a))
N(Cr2O72-) = 8,156.10-6 x 2/3 = 5,435.10-6 mol
M(Cr2O72-) = 5,435.10--6 x 294 = 1,60 g
Cette quantité de bichromate correspond à la moitié de celle contenue dans le tube.