Avancement d'une réaction d'oxydoréduction (inspiré de bac Nouvelle-Calédonie 2004)
Les ions iodure (
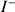 ) réagissent avec les ions peroxodisulfate (
) réagissent avec les ions peroxodisulfate (
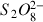 ) :
) :
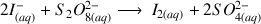 (1)
(1)
Un volume
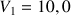 mL de solution aqueuse d'iodure de potassium (
mL de solution aqueuse d'iodure de potassium (
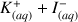 ) de concentration molaire en soluté apporté
) de concentration molaire en soluté apporté
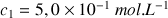 et un volume
et un volume
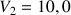 mL de solution aqueuse de peroxodisulfate de sodium (
mL de solution aqueuse de peroxodisulfate de sodium (
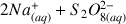 ) de concentration molaire en soluté apporté
) de concentration molaire en soluté apporté
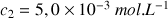 sont mélangés pour former la solution S.
sont mélangés pour former la solution S.
Cette réaction a une cinétique assez lente et on décide d'analyser au bout de 30 min le mélange obtenu. On dose le diiode restant. Pour cela on introduit dans un erlenmeyer contenant de l'eau glacée un échantillon de volume
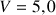 mL du mélange réactionnel S. A l'aide d'une solution étalon de thiosulfate de sodium (
mL du mélange réactionnel S. A l'aide d'une solution étalon de thiosulfate de sodium (
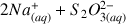 ) de concentration molaire en soluté apporté
) de concentration molaire en soluté apporté
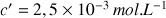 , on titre le diiode présent dans l'échantillon en présence d'un indicateur de fin de réaction. L'équivalence est atteinte pour un volume
, on titre le diiode présent dans l'échantillon en présence d'un indicateur de fin de réaction. L'équivalence est atteinte pour un volume
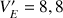 mL.
mL.
L'équation associée à la réaction support du titrage est :
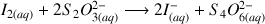 (2)
(2)
Question
Pour les réactions (1) et (2) écrire les demi-équations des couples mises en jeu.
Réaction (1) :
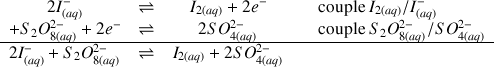
Réaction (2) :
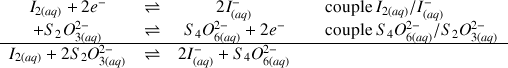
Question
Si l'avancement de la réaction (1) est total, quelle quantité de
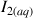 doit-être formée ?
doit-être formée ?
Nombre initial de iodure :
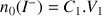
A.N.
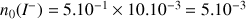 mol
mol
Nombre initial de peroxodisulfate :
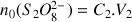
A.N.
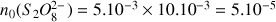 mol
mol
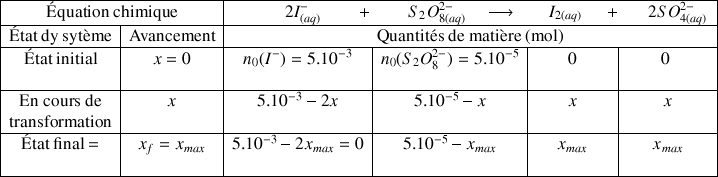
Recherche du réactif limitant :
Si
 réactif limitant :
réactif limitant :
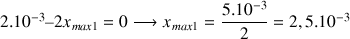 mol
mol
Si
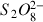 réactif limitant :
réactif limitant :
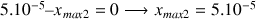 mol
mol
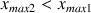 donc
donc
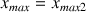
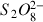 est le réactif limitant
est le réactif limitant
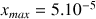 mol
mol
Si la réaction est totale la quantité maximale de
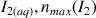 , qui peut être formée est égale à
, qui peut être formée est égale à
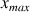 (voir tableau d'avancement)
(voir tableau d'avancement)
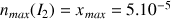 mol
mol
Question
3) Calculer la quantité de
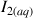 formée au bout de 30 min à partir du dosage utilisant la réaction (2). Que peut-on dire de l'avancement de la réaction ?
formée au bout de 30 min à partir du dosage utilisant la réaction (2). Que peut-on dire de l'avancement de la réaction ?
Le volume de la solution S du premier mélange est de 20 mL (
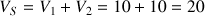 mL)
mL)
On a prélevé 5 mL de cette solution et dosé la quantité de
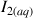 en versant un volume
en versant un volume
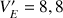 mL de thiosulfate
mL de thiosulfate
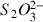 selon la réaction :
selon la réaction :
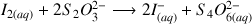 (2)
(2)
A l'équivalence on a versé
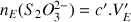
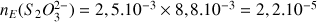 mol
mol
L'équivalence (
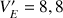 mL) correspond à un mélange stoechiométrique des deux réactifs
mL) correspond à un mélange stoechiométrique des deux réactifs
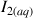 et
et
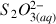 .
.
Les deux réactifs sont donc limitants :
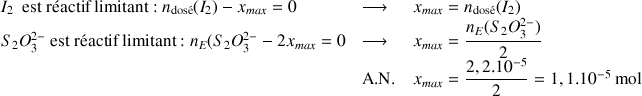
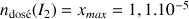 mol
mol
La quantité de diiode
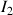 dans la solution de départ S est
dans la solution de départ S est
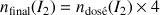 (on a dosé la quantité de
(on a dosé la quantité de
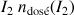 en prélevant 5 mL de solution S (
en prélevant 5 mL de solution S (
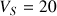 mL), la quantité totale de
mL), la quantité totale de
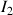 est donc quatre fois plus grande)
est donc quatre fois plus grande)
Dans la solution S le nombre de mole formé de
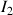 est
est
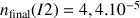 mol
mol
Le taux d'avancement est
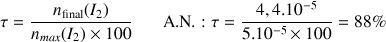
Au bout de 30 mn la transformation n'est pas encore terminée (la réaction est totale, on doit tendre à la fin vers la valeur
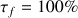 )
)






