Préparation d'une solution aqueuse
Définition : Solution aqueuse
Une solution aqueuse est obtenue par dissolution d'une espèce chimique, appelée soluté, dans un grand volume d'eau. L'eau joue le rôle de solvant.
Avant dissolution, l'espèce chimique qui jouera le rôle de soluté peut être un solide (ex : NaCl ou saccharose), un liquide (ex : acide acétique ou éthanol) ou un gaz (ex : ammoniac ou HCl).
Dissolution d'un solide
Après dissolution d'un solide, une solution peut contenir
des molécules, ex :

des ions, ex :
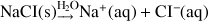
Les symboles (s) et (aq) signifient que le composé est respectivement sous forme solide ou dissous dans l'eau (il joue le rôle de soluté et l'eau de solvant). « aq » est l'abréviation de « aqueux ». Si le solide se dissocie dans l'eau sous forme d'ions (ex NaCl ci-dessous) ceux-ci seront sous forme aqueuse (entourés de molécules d'eau).
Dissolution liquide ou gaz
on utilisera le symbole
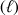 dans le cas d'un liquide et (g) pour un gaz. L'espèce dissoute étant repérée par le symbole (aq).
dans le cas d'un liquide et (g) pour un gaz. L'espèce dissoute étant repérée par le symbole (aq).

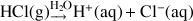
Exemple :
Préparation de 200 mL d'une solution aqueuse de saccharose de concentration molaire Csacch. = 10-2 mol.L-1.
On dispose d'une fiole jaugée de volume Vfiole = 200 mL et de poudre de saccharose (C12H22O11, M = 342 g.mol-1)
Quantité de matière
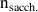 à mettre dans la fiole jaugée :
à mettre dans la fiole jaugée :
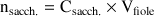
A.N. :

Il faut peser la poudre qui correspond à cette quantité de matière :
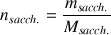 donc
donc

A.N. :
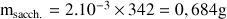
Donc pour préparer cette solution il faut verser 0,684 g de saccharose dans la fiole jaugée de 200 mL et la compléter en eau. Il faudra faire attention à bien dissoudre le saccharose dans l'eau (agitation de la fiole bouchée).
Remarque : Concentration molaire apportée et effective
Au cours de la dissolution d'une espèce chimique dans l'eau celle-ci peut se dissocier sous formes d'ions (voir partie solutions électrolytiques).
La concentration calculée à partir de la quantité de matière de l'espèce chimique avant dissociation sera appelée concentration molaire apportée et celle des espèces en solution concentration molaire effective.
Exemple de la dissolution de
 dans l'eau avec
dans l'eau avec

On dissout 1,622 g de
 dans une fiole jaugée de 100 mL.
dans une fiole jaugée de 100 mL.
Donc

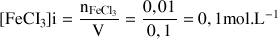 C'est la concentration apportée en
C'est la concentration apportée en

L'équation de dissociation est :

Tableau d'avancement (voir ci-dessous partie tableau avancement).
Équation de la réaction | FeCl3(s) |
| Fe3+(aq)+ | 3Cl-(aq) | |
|---|---|---|---|---|---|
État du système | Avancement | Quantité de matière en mole | |||
Initial | x = 0 | n0 | 0 | 0 | |
En cours | x | n0-x | x | 3x | |
Final | xmax = n0 | n0-xmax=0 | xmax=n0 | 3xmax=3n0 | |
Concentrations effectives des ions Fe3+ et Cl- après dissolution :
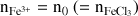 concentration molaire effective donc [Fe3+] = n0/V = 0,1 mol.L-1 ( = [FeCl3]i)
concentration molaire effective donc [Fe3+] = n0/V = 0,1 mol.L-1 ( = [FeCl3]i)
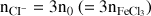 concentration molaire effective donc [Cl-] = 3n0/V = 0,3 mol.L-1 ( = 3×[FeCl3]i)
concentration molaire effective donc [Cl-] = 3n0/V = 0,3 mol.L-1 ( = 3×[FeCl3]i)








