Définitions
Définition : Un réducteur
Un réducteur est une entité (atome, ion, molécule) qui perd des électrons.
Définition : Un oxydant
Un oxydant est une entité (atome, ion, molécule) qui gagne des électrons.
Définition : Une oxydation
Une réaction d'oxydation est une réaction au cours de laquelle des électrons sont perdus.
Définition : Une réduction
Une réaction de réduction est une réaction au cours de laquelle des électrons sont gagnés.
Définition : couple oxydant/réducteur
Un couple redox (couple oxydant/réducteur) est formé des espèces dites conjuguées Ox (Oxydant) et Red (Réducteur) reliées par la demi-équation d'oxydoréduction :
Ox + ne- ⇌ Red (forme plus générale : aOx + ne- + m H+ ⇌ bRed + q H2O)
On notera le couple rédox toujours dans le même ordre: Ox/Red (Oxydant puis Réducteur conjugué).
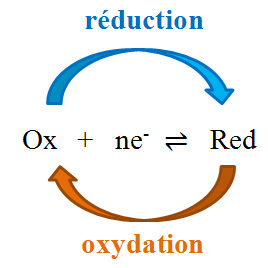
Un oxydant capte des électrons pour devenir un réducteur : il subit une réduction.
Un réducteur cède des électrons pour devenir un oxydant : il subit une oxydation.
Complément d'information
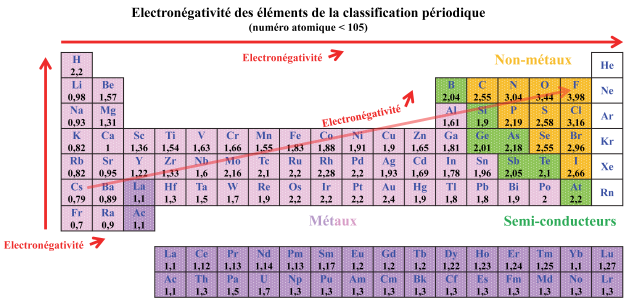
L'électronégativité est la capacité d'un élément chimique à attirer à lui les électrons.
Plus cette valeur est grande et plus l'élément chimique aura la capacité à attirer à lui les électrons. Dans le tableau périodique le fluor possède la plus grande électronégativité et le césium la plus petite.
L'électronégativité des éléments augmente quand on monte dans une colonne du tableau périodique et quand on se déplace de gauche à droite dans une période.
D'après les définitions indiquées ci-dessus un élément ayant une électronégativité importante sera un oxydant.
Les non-métaux qui sont situés en haut à droite du tableau périodique sont des oxydants
Les métaux qui sont situés à gauche dans le tableau périodique sont des réducteurs.
Exemple : Cs(s) + ½ F2(g) → CsF(s) solide dans lequel on retrouve les ions Cs+ (Cs a cédé un électron, il est réducteur dans la réaction) et F- (F a capté un électron, il est oxydant dans la réaction).
Figure à consulter : Tableau Périodique avec métaux non-métaux et électronégativité.