Écriture d'une réaction d'oxydoréduction
Définition : Une réaction d'oxydoréduction
Une réaction d'oxydoréduction est une réaction d'échange d'électrons entre 2 couples redox.
Fondamental :
Au cours d'une réaction d'oxydoréduction, l'oxydant d'un couple réagit avec le réducteur d'un autre couple. L'oxydant et le réducteur s'échangent les électrons. Les électrons n'apparaissent pas dans l'écriture de l'équation bilan.
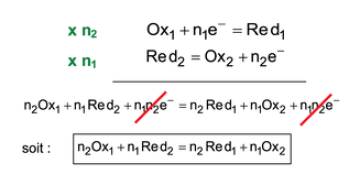
Considérons les 2 couples Ox1/Red1 et Ox2/Red2.
Pour écrire la réaction entre Ox1 et Red2, il faudra que Ox1 et Red2 s'échangent le même nombre d'électrons. Il faut donc trouver ce nombre commun d'électrons échangés. On peut par exemple appliquer le facteur multiplicatif n2 à la demi-équation du couple redox 1 et le facteur multiplicatif n1 à la demi-équation du couple couple redox 2.
L'équation bilan s'obtient alors en effectuant la somme terme à terme.
Méthode : Écriture d'une réaction redox entre Ox1 et Red2
Écrire la demi-équation du couple redox 1 dans le sens : Ox1 ⇌ Red1
Écrire la demi-équation du couple redox 2 dans le sens : Red2 ⇌ Ox2
Trouver le nombre commun d'électrons échangés
Appliquer le facteur multiplicatif adéquat à chaque demi-équation
Effectuer la somme terme à terme
Vérifier que l'équation bilan est bien équilibrée
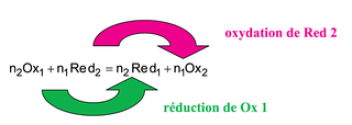
Lors d'une réaction d'oxydoréduction, il y aura simultanément :
oxydation du réducteur 2
réduction de l'oxydant 1
Écrire les réactions redox suivantes :
Exemple :
Écrire la réaction redox ayant lieu entre Fe3+ et I-
Les couples redox à envisager sont Fe3+/Fe2+ et l2/l-.
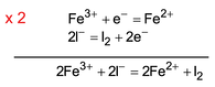
Toujours penser à vérifier que la réaction est bien équilibrée !
C'est bien le cas pour Fe, l.
Décompte des charges :
+ 6 – 2 = + 4, soit 4 charges positives à gauche du signe «
 »
»+ 4, soit 4 charges positives à droite du signe «
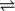 »
»
Exemple :
Écrire la réaction redox ayant lieu entre l- et MnO4-
Les couples redox à envisager sont l2/l- et MnO4- = Mn2+
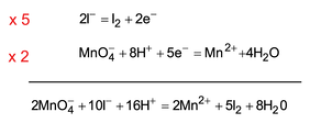
Toujours penser à vérifier que la réaction est bien équilibrée !
C'est bien le cas pour Mn, I, H et O.
Décompte des charges :
- 2 - 10 + 16 = + 4, soit 4 charges positives à gauche du signe «
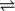 »
»
+ 4, soit 4 charges positives à droite du signe «
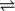 »
»
Attention :
Ne pas confondre la demi-équation d'un couple et une réaction redox !
La demi-équation d'un couple redox traduit un échange d'électrons entre l'oxydant et le réducteur du même couple redox. Les électrons apparaissent dans l'écriture.
Une réaction redox traduit un échange d'électrons entre l'oxydant et le réducteur appartenant à 2 couples redox différents. Les électrons n'apparaissent pas dans l'écriture.






