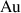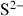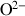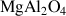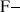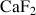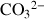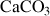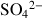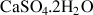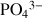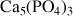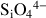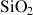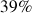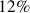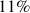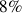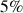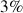Minéralogie
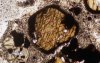
Les minéraux terrestres sont divisés en 8 classes : les Eléments natifs, les Sulfures, les Oxydes, les Halogénures, les Carbonates et Borates, les Sulfates, les Phosphates et les Silicates. Leurs cristallisations et composition chimique traduisent des contextes physico-chimiques de mise en place variés depuis des conditions oxydantes, réductrices, de haute ou basse température et pression, en milieu hydraté ou non etc.
Classe minérale | Anions | Exemple | Formule |
|---|---|---|---|
Éléments natifs | aucun | Or |
|
Sulfures |
| Pyrite |
|
Oxydes |
| Spinelle |
|
Halogénures |
| Fluorine |
|
Carbonates et borates |
| Calcite |
|
Sulfates |
| Gypse |
|
Phosphates |
| Apatite |
|
Silicates |
|
|
Distribution des minéraux constitutifs de la lithosphère terrestre
Parmi ces classes, les silicates représentent 92% des minéraux constitutifs de la lithosphère c'est à dire de la croûte et de la partie solide du manteau supérieur (voir tableau ci-dessous).
Parmi les silicates, 7 minéraux dominent et sont respectivement et par ordre de fréquence décroissant : les Plagioclases (39%), les Feldspaths alcalins (12%), le Quartz et dérivés (12%), les Pyroxènes (11%), les Amphiboles (5%), les Micas (5%) les Argiles (5%) soit 89% du total, le reste des silicates ne comptant que pour 3%.
Cette distribution peut s'expliquer par l'abondance de certains éléments chimiques de la Terre. En effet, 8 éléments chimiques (Figure 4) reflètent 99,999% en volume et 96% en poids de la Terre.

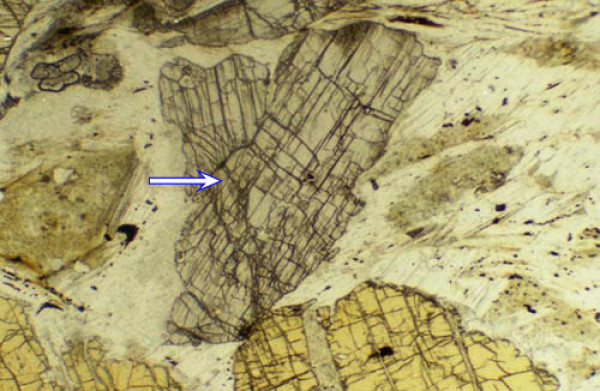
Cette distribution élémentaire montre que l'environnement géochimique est dominé par l'oxygène (46,6% pondéral) et le silicium (27,72% pondéral). L'édifice iono-covalent d'un cristal inorganique le plus stable du point de vue thermodynamique de ces 2 éléments est le tétraèdre formé d'un atome de silicium entouré à équidistance de 4 atomes d'oxygène pour former
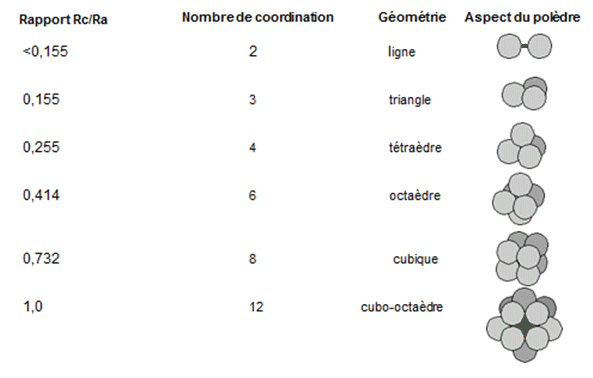
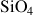 électriquement neutre. D'autres structures sont possibles mais n'assurent pas la meilleure thermo-stabilité de l'édifice en fonction des rapports ioniques (Rc/Ra) selon la règle de Pauling (Figure 5) :
électriquement neutre. D'autres structures sont possibles mais n'assurent pas la meilleure thermo-stabilité de l'édifice en fonction des rapports ioniques (Rc/Ra) selon la règle de Pauling (Figure 5) :
Rappel : Rappel de la règle de Linus Pauling (1929)
Un polyèdre d'anions de coordination est formé autour de chaque cation (et vice-versa) :
Il sera stable si le cation est au contact de chacun de ses voisins.
Les cristaux ioniques peuvent alors être considérés comme des assemblages de polyèdres connectés.
La distance cation-anion est considérée comme la somme des rayons ioniques.