Contrôle de qualité dans le REr
A) Contrôle des protéines N–glycosylées (glycosylation sur une asparagine)
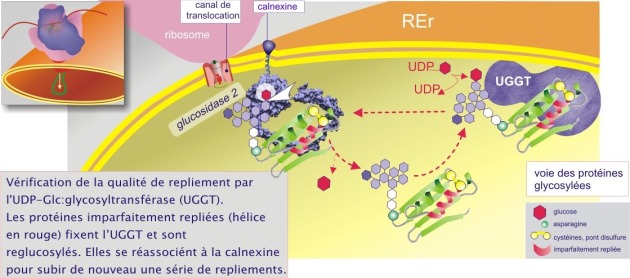
Les lectines chaperonnes agissent de concert avec a/ l'alpha–glucosidase–2 dont le rôle est de détacher un résidu glucose de la cupule glucidique (« core glycan »), libérant ainsi la protéine cliente et b/ l'UGGT (UDP–glucose : glycoprotein glucosyltransférase), enzyme qui a pour unique rôle de reconnaître à la fois la cupule glucidique (dépourvue de glucose) et des segments amino acidiques hydrophobes de 20-30 résidus, typique des protéines presque définitivement repliées (conformation « native-close » ou « molten globule-like », voir figure 11). L'UGGT est donc appelé pour cela le détecteur de repliement du REr (« folding sensor »). Les protéines imparfaitement repliées sont alors reglucosylées et réassociées à la calnexine (ou à la calréticuline) pour subir de nouveau une série de repliements qui leur confèreront leur état définitif (« native state ») (voir figure 10A). La durée de ces processus est de l'ordre de la minute à l'heure. Ce cycle se termine quand une mannosidase type I (à « activité lente ») détache un résidu mannose de la branche médiane de la cupule glucidique :GlcNac2 - Man9 --> GlcNac2 – Man8 ) évitant ainsi la réassociation avec l'UGGT.
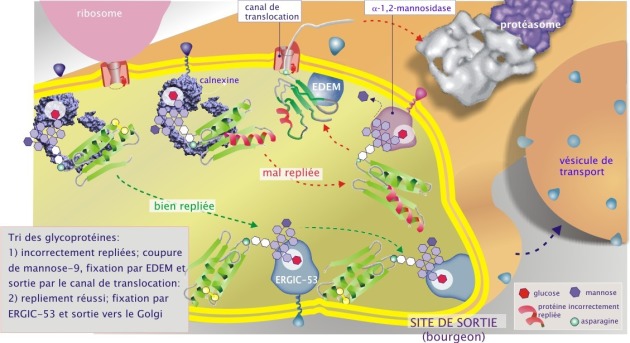
Les protéines mal repliées et modifiées par la mannosidase–1 (possédant donc maintenant une cupule glucidique de GlcNac2–Man8) sont reconnues par l'EDEM (ER–degradation enhancing \(\alpha\)–mannosidase–like protein), lectine liée à la calnexine par son domaine transmembranaire (ce qui explique pourquoi elle ne se complexe pas avec la calréticuline qui est une protéine soluble). Par cela, les protéines défectueuses sont destinées à sortir du REr par le canal de translocation (Sec61\(\alpha\)), ubiquitinées (l'identité de l'ubiquitine ligase n'est pas encore connue) puis détruites par le protéasome dans le cytoplasme (voir figure 10B). Environ la moitié des protéines qui transitent par le REr sont détruites par cette voie.
Si la glycoprotéine est bien repliée, elle est reconnue par la lectine ERGIC–53 (aussi nommée « p58 ») et transportée vers le Golgi.
Remarque : Mannosidase type 1
La mannosidase type 1 du REr est une protéine transmembranaire à N–terminal cytosolique, dépendante du Ca2+ et membre de la famille des glycosylhydrolases (dont il existe 47 membres). Elle a la particularité de posséder une arginine en position 273 dans son site catalytique, ce qui lui confère sa préférence pour le mannose 9 de la branche médiane. En revanche, les mannosidases résidant dans le Golgi ont une leucine en position 273 dans leur site catalytique qui leur permet de couper les mannoses des trois branches de la cupule glucidique.
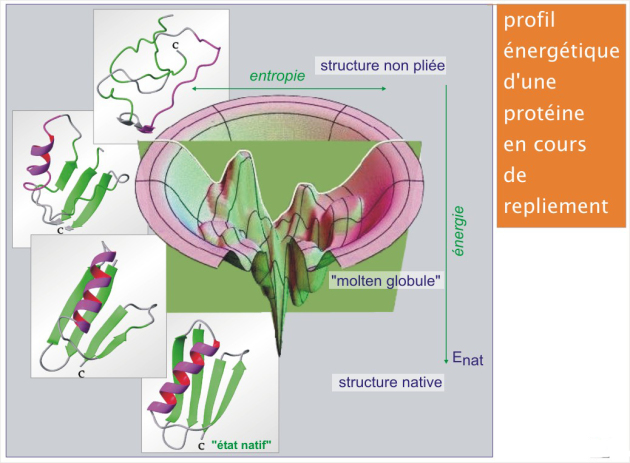
Profil énergétique d'une protéine en cours de repliement
Les différentes étapes (hypothétiques) du repliement d'une protéine naissante et leurs niveaux d'énergie sont illustrées dans la figure 11 (revoir aussi le repliement des protéines [pdf] de la ressource « Synthèse et dégradation des protéines »).
B) Contrôle des protéines non-glycosylées
Ces protéines sont soumises à un autre contrôle de qualité dont on sait généralement peu de choses. Les chaperonnes les plus abondantes dans le REr, telles que BiP et Grp94, sont supposées intervenir. De plus, quelques exemples ponctuels peuvent être cités : les collagènes interagissent avec la protéine chaperonne Hsp47 ; la lipoprotéine à faible densité (R–LDL) s'associe à RAP (receptor associated protein) puis est dirigée vers le Golgi ; enfin, le complexe majeur d'histocompatibilité classe I (CHM classe I) est retenu dans le REr par la tapasine et le TAP (transporter associated with antigen processing) jusqu'à son association à l'antigène.
![]() Pour en savoir plus, consultez les documents suivants : Caramelo UGGT near native folding [pdf] (237 Ko), et Braakman protein folding [pdf] (179 Ko).
Pour en savoir plus, consultez les documents suivants : Caramelo UGGT near native folding [pdf] (237 Ko), et Braakman protein folding [pdf] (179 Ko).
L'homéostasie protéique (« protéostasie ») est essentielle pour le bon fonctionnement de la cellule. Il a été montré qu'un défaut de production, de repliement, d'acheminement ou encore d'agrégation des protéines dans le REr peut avoir des conséquences graves pour l'organisme comme témoigné par des pathologies telles que la maladie d'Alzheimer, de Parkinson et de Huntington ainsi que la mucoviscidose.
![]() Pour en savoir plus, consultez le document suivant : Powers ER proteostasis deficiency and disease [pdf] (2,17 Mo).
Pour en savoir plus, consultez le document suivant : Powers ER proteostasis deficiency and disease [pdf] (2,17 Mo).