Les protéines chaperonnes : leur rôle dans le repliement
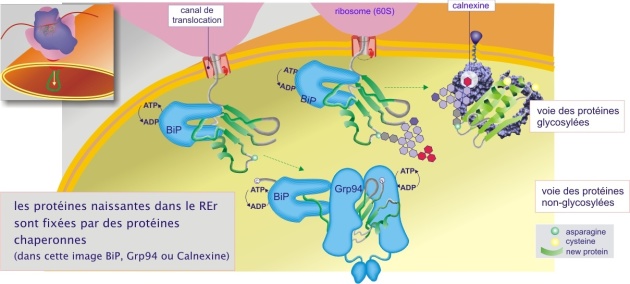
Le REr contient de nombreuses protéines chaperonnes qui sont capables de reconnaître des domaines de protéines naissantes dans leur état provisoire et d'assurer leur repliement approprié. Parmi elles, la plus abondante protéine du REr, est la BiP (binding protein) aussi appelée Grp78 (glucose regulated protein–78) un orthologue de la Hsp70 cytosolique. L'appellation « binding protein » vient du fait que, lors de son identification, cette protéine était systématiquement liée à la chaîne lourde des immunoglobulines (Ig) produites par le lymphocyte B. Dans le REr on trouve également la Grp94, orthologue de la Hsp90 cytosolique (voir figure 6).
L'interaction d'une chaperonne avec sa protéine cliente est étroitement dépendante de l'ATP dont l'hydrolyse (en ADP et Pi) assure un cycle d'événements d'association et de dissociation des deux protéines ( pour plus de détail). Le cycle est régulé par des protéines accessoires qui sont des facteurs qui catalysent l'hydrolyse (« ATPase activating factor » tels que ERdj3) et des facteurs qui catalysent l'échange d'ADP par ATP (Adenine exchange factor tels que Bag–1).
Un autre groupe abondant est représenté par des chaperonnes qui possèdent un domaine lectine se liant donc spécifiquement à certains résidus glucidiques (glucose ou mannose pour le REr). La calréticuline est une lectine chaperonne soluble alors que la calnexine est une protéine transmembranaire ( pour plus de détail sur la Calnexine). Ces deux lectines chaperonnes n'ont pas d'équivalents dans d'autres compartiments cellulaires. Leur rôle dans le repliement est évoqué dans la section « la glycosylation »)
Remarque :
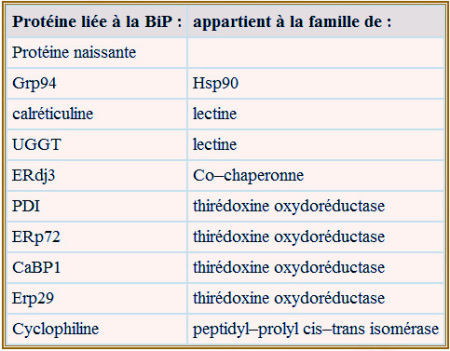
Dans la lumière du REr de nombreuses protéines prennent en compte les modifications et le repliement de protéines néo synthétisées. Elles font partie d'un grand complexe qui entoure la chaîne de la protéine naissante dès qu'elle pénètre dans le REr (voir tableau ci-dessous). Le nombre de ces protéines dépasse celui des protéines naissantes si bien que d'éventuels agrégats néfastes à la vie de la cellule sont évités. Dans les paragraphes suivants, nous présenterons les différents aspects du repliement des protéines sous forme d'une séquence apparemment chronologique, en étant cependant conscient que la plupart des processus décrits peuvent se dérouler simultanément (et dans un même site).
Remarque : Chaperonnes en série
Il est possible que les chaperonnes agissent en série : d'abord Grp78 qui a une forte affinité pour des segments hydrophobes (7-8 acides aminés) dans les protéines non pliées, puis Grp94, qui interagit avec la protéine partiellement pliée, vraisemblablement par l'intermédiaire d'un doigt amphiphatique qui s'insère dans une fente ou crevasse de la protéine cliente.
Complément : Excursion : découverte des chaperonnes
Les protéines chaperonnes furent identifiées pour la première fois par Laskey et ses collègues alors qu'ils étudiaient la fonction de la nucléoplasmine, protéine acide nécessaire à l'assemblage du nucléosome à partir d'ADN et d'histones (obtenus à partir d'ovocytes de Xenopus laevis) sans être composant du complexe mature. Des travaux de Laskey et de ses collègues, il ressort que la nucléoplasmine favorise les interactions histone-histone en reduisant la répulsion électrostatique. Elle prévient aussi la formation d'agrégats non-spécifiques insolubles en contrariant la forte attraction électrostatique entre histones et ADN. Le qualificatif « chaperonne » fait référence à la personne âgée qui, par le passé, accompagnait les jeunes filles non mariées dans les activités publiques, leur évitant les contacts indésirables.
R. A. Laskey, B. M. Honda, A. D. Mills, and J. T. Finch, « Nucleosomes Are Assembled by an Acidic Protein Which Binds Histones and Transfers Them to DNA », Nature 275 (1978) : 420.
![]() Pour en savoir plus, consultez le document suivant : Unfolded protein response [pdf] (131 Ko), qui présente des données sur la façon dont le REr communique avec le noyau pour contrôler l'expression des chaperonnes.
Pour en savoir plus, consultez le document suivant : Unfolded protein response [pdf] (131 Ko), qui présente des données sur la façon dont le REr communique avec le noyau pour contrôler l'expression des chaperonnes.