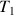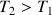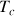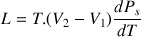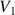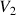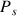Rappels théoriques
Equilibre d'un corps pur sous deux phases:
Deux corps sont en équilibre si:
leurs températures sont égales
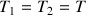
leurs pressions sont égales:
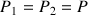
leurs potentiels chimiques sont égaux:
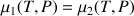
P est donc uniquement fonction de T: le système est dit monovariant.
Courbes d'équilibre d'un corps pur sous deux phases:
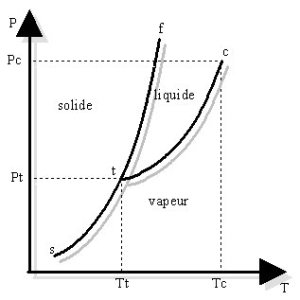 | Les courbes d'équilibre représentées ci-contre sont:
Si le point représentatif d'un corps pur M(T,P) appartient à l'une des trois courbes, on aura un équilibre entre deux phases du corps sinon le corps existe sous une seule phase. Le passage d'une phase à l'autre est un processus réversible qui s'effectue à température et pression constantes. La fusion (solide->liquide) , la vaporisation (liquide->vapeur) et la sublimation (solide -> vapeur) s'accompagnent d'une absorption de chaleur (transfromation endothermique); la transformation inverse s'accompagne d'une libération de chaleur (transformation exothermique). Cette chaleur est la chaleur latente L de changement d'état. |
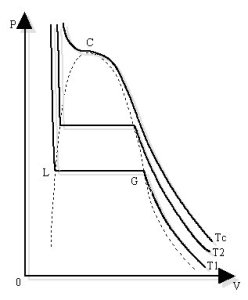
Equilibre liquide-vapeur. Point critique.
Nous avons représenté ci-contre, dans le diagramme (P,V) trois isothermes. Si l'on suit, par exemple, l'isotherme
Sur ce palier GL, on a deux phases: liquide et vapeur dite "saturante"; quand on passe de G à L, la température et la pression restent constantes, la proportion du corps sous forme vapeur diminue, celle sous forme liquide augmente. En L, on n'a plus que la forme liquide. Le liquide étant peu compressible, P augmente alors très vite quand V diminue. Pour
A la température critique
Le lieu des points G est la courbe de rosée. Le lieu des points L est la courbe d'ébullition. Ces courbes sont représentées en pointillés. La chaleur latente de ce changement d'état liquide -> vapeur est donnée par la formule de Clapeyron:
où
|