Isotopes d'un élément
Contrairement à ce que pensait Dalton, certains atomes d'un même élément ne sont pas constitués du même nombre de neutrons et ont donc des valeurs de A et des masses différentes. On appelle isotopes[1] d'un élément, des atomes de cet élément différant par le nombre de neutrons dans leur noyau. Des isotopes sont donc caractérisés par des valeurs de Z identiques mais des valeurs de A et N différentes.
Exemple :
L'élément hydrogène possède trois isotopes :
 ,
,
 et
et
 dont les deux derniers sont appelés respectivement deutérium et tritium et notés en abrégés D et T. Seuls ces deux isotopes de l'hydrogène possède des noms particuliers.
dont les deux derniers sont appelés respectivement deutérium et tritium et notés en abrégés D et T. Seuls ces deux isotopes de l'hydrogène possède des noms particuliers.
Un isotope est nommé sous la forme suivante : isotope A de(du) nom de l'élément
Exemple :
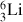 est l'isotope 6 du lithium.
est l'isotope 6 du lithium.
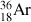 est l'isotope 36 de l'argon.
est l'isotope 36 de l'argon.






