3.2.5.2 - Les remaniements chromosomiques
Effets d'une délétion
Une délétion entraîne la perte d'information génétique. Ses effets sont très dépendants de la taille et de la nature de la région perdue. Cependant elle n'a de chance d'être maintenue au cours des générations que dans des circonstances bien particulières. Le rôle dans l'évolution est limité.
Effets des additions
A l'inverse, les additions jouent un rôle essentiel dans la mise en place de fonctions nouvelles, qu'il s'agisse d'un transfert horizontal (gain d'une séquence à partir d'une autre espèce) ou de duplications.
Effet des inversions et des translocations
Les inversions et translocations ne provoquent a priori ni perte ni gain d'information. Leur effet devrait être nul. Pourtant 3 points importants contredisent cette intuition :
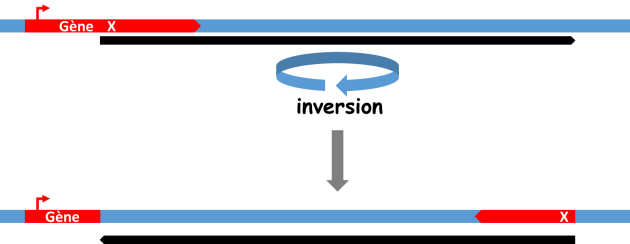
1 : La nature des séquences aux points de cassure est importante, s'il s'agit par exemple d'une séquence génique, celle-ci s'en trouvera séparée en deux morceaux devenus non fonctionnels (fig. 3.30).
2 : La modification de la localisation chromosomique d'un gène n'est pas anodine et est susceptible d'influencer son expression.
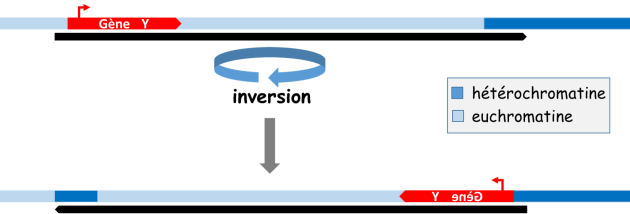
Des sites d'attachement de l'ADN à la matrice nucléaire structurent le génome en boucles contenant des gènes soumis à des régulations communes. (fig. 3.31)

Par ailleurs la position d'un gène par rapport aux zones hétérochromatiques (centromères, télomères entre autres) est un facteur important de sa régulation (fig. 3.32).
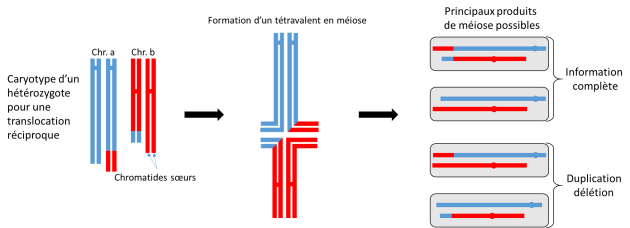
les inversions et translocations provoquent des modifications de l'appariement en méiose pour des hybrides. Une partie des produits de méioses sont alors porteurs d'anomalies (fig. 3.33).
Cette difficulté peut participer à l'isolement entre deux populations, l'une ayant conservé la structure chromosomique initiale, l'autre ayant adopté la nouvelle structure. Ce phénomène peut donc intervenir dans le processus de spéciation.
Cas particulier des duplications de gènes
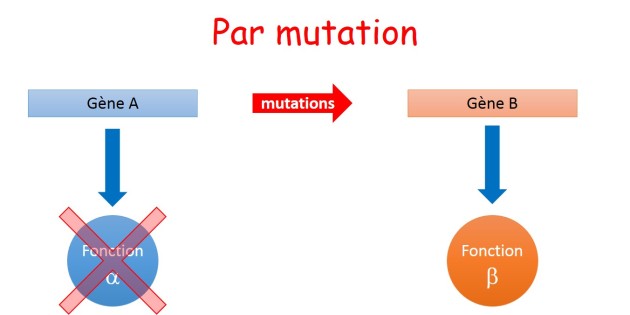
La transformation progressive d'un gène par mutation est compatible avec une vision actuelle de l'évolution. Le maintien de la fonction initiale accompagnée de la création d'une fonction nouvelle est envisageable (fig. 3.34). Le développement de l'épissage alternatif chez les eucaryotes est un exemple de diversification d'une fonction à partir d'une séquence unique .
Cependant, le plus probable serait que l'apparition d'une fonction nouvelle s'accompagne de la perte de la fonction initiale. Il s'agirait alors non pas d'une complexification mais d'une transition (fig. 3.35).
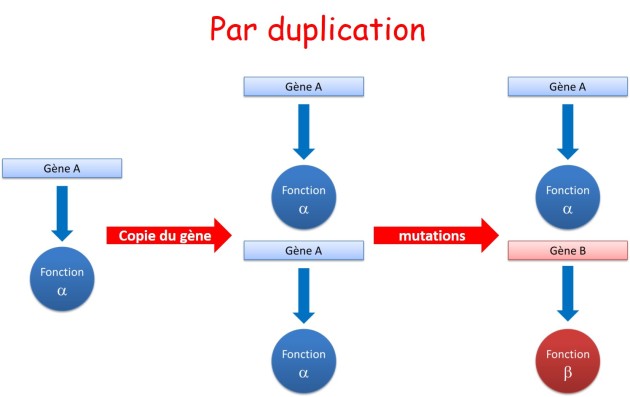
La duplication de gène devient alors un mécanisme économe pour augmenter la complexité d'un organisme et développer de nouvelles fonctions (fig. 3.36).
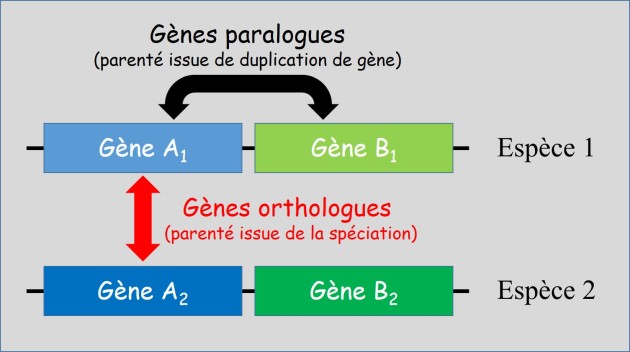
Ce mécanisme est à l'origine de ce qui est appelé les familles multigéniques. Elles regroupent en général des gènes fréquemment situés en tandem sur les chromosomes et produisant des protéines de fonctions apparentées. On parle alors de gènes paralogues pour les copies trouvées dans le génome d'une même espèce et de gènes orthologues pour les gènes de même origine évolutive trouvés dans deux espèces (fig. 3.37).
L'exemple typique et célèbre de gènes paralogues est celui de gènes de globines.
Exemple : Exemple de la duplication des gènes de globines
Le réassortiment d'exons (exon shuffling)
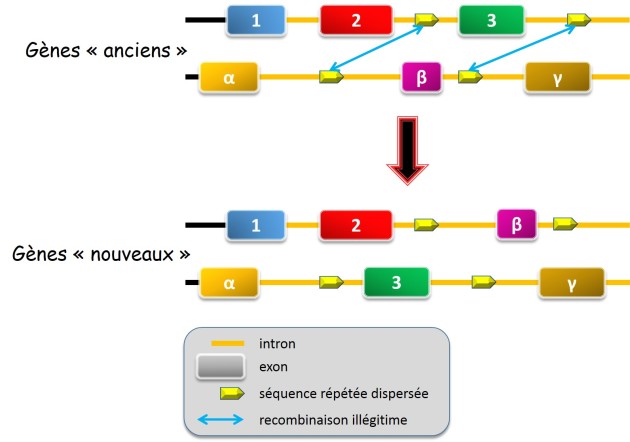
Évoqué pour la première fois par W. Gilbert[1] fin des années 1970', ce processus consisterait dans la ré-association d'exons indépendants grâce à des recombinaisons entre introns (fig. 3.38). La présence dans les génomes de nombreuses séquences répétées dispersées (e.g. éléments transposables telles que les séquences alu chez l'Homme) pourrait participer à ce processus. Il n'est en effet pas rare de trouver de telles séquences dans les introns.
des recombinaisons entre séquences introniques répétées pourrait permettre de reconstituer de nouveaux gènes et ainsi de permettre l'émergence de nouvelles fonctions
Une correspondance entre les régions fonctionnelles des protéines et les exons des gènes a été constatée pour une série de protéines intervenant dans la réaction de coagulation du sang et la lyse du caillot ( Furie & Furie, 1988[2], rapporté par Solignac et al., 1995[3]). Il s'agit d'un argument fort en faveur de cette hypothèse. Ainsi, des propriétés élémentaires associées à de courts domaines protéiques pourraient être ré-associées pour créer de nouvelles fonctions.