1-4. Stabilisateurs d'émulsions
Cette partie présente les différents phénomènes pouvant stabiliser une émulsion.
1.4.1 Les effets stabilisateurs
Des substances peuvent être ajoutées à la phase hydrophile et lipophile pour faciliter l'émulsion et/ou participer à sa stabilisation. Ces substances stabilisent l'interface entre les gouttelettes dispersées et la phase dispersante et/ou limitent la rencontre entre les gouttelettes dispersées.
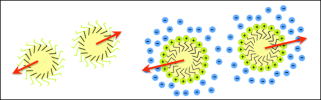
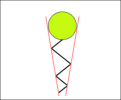
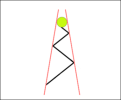
Il existe plusieurs mécanismes de stabilisation (voir Figure 19) :
- La stabilisation stérique.
- La stabilisation électrostatique.
Figure 19 – Schémas d'une stabilisation stérique et électrostatique
1.4.2 Les émulsifiants
• Les tensioactifs
Définition : Un tensioactif, également appelé agent de surface ou surfactant, est un composé amphiphile capable de modifier la tension superficielle entre deux surfaces.
Les tensioactifs peuvent jouer plusieurs rôles dans une émulsion. En effet, ils peuvent jouer le rôle d'émulsifiant, de moussant, de mouillant ou encore de détergent en fonction de leur nature et de la phase, hydrophile ou lipophile, dans laquelle ils se trouvent.
Il est donc important de faire la distinction entre un émulsifiant et un tensioactif pour deux raisons :
- Les tensioactifs ne sont pas tous utilisés comme des émulsifiants.
- Il existe des émulsifiants qui ne sont pas des tensioactifs.
Les tensioactifs sont constitués d'une tête hydrophile et d'une queue hydrophobe et se placent à l'interface des phases hydrophiles et lipophiles de l'émulsion.
La tête hydrophile forme des liaisons hydrogènes et ioniques avec la phase hydrophile tandis que la queue hydrophobe forme des liaisons de Van der Waals et des interactions hydrophobes avec la phase lipophile. Ce phénomène a pour effet de diminuer la tension interfaciale.
Les tensioactifs peuvent être représentés de 2 manières différentes : en fonction de la taille de la tête hydrophile ou celle de la queue hydrophobe (voir Figures 20 et 21).
Figure 20 – Tensioactif hydrophile
Figure 21 – Tensioactif lipophile
Le tensioactif impose une courbe spontanée de l'interface huile/eau. Les figures 22 et 23 représentent l'organisation des tensioactifs dans une émulsion L/H et H/L
Figure 22 – Gouttelette lipophile stabilisée par un tensioactif hydrophile
Figure 23 – Gouttelette hydrophile stabilisée par un tensioactif lipophile
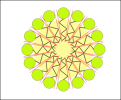
Dans certains cas les tensioactifs s'associent pour former des structures appelées micelles. Le nombre de tensioactifs par micelle peut varier de quelques dizaines à une centaine et leur diamètre est compris entre quelques nanomètres à quelques dizaines de nanomètre.
Les tensioactifs hydrophiles forment des structures appelées micelles (voir Figure 24) et les tensioactifs lipophiles forment des structures appelées micelles inversées (voir Figure 25).
Figure 24 – Micelle hydrophile
Figure 25 – Micelle inversée (hydrophobe)
L'organisation des tensioactifs dans une émulsion dépend de la concentration en tensioactif et de la température. La concentration à laquelle les micelles se forment spontanément est appelée concentration micellaire critique (CMC)
Les tensioactifs sont répartis en 2 catégories :
- Les tensioactifs ioniques.
- Les tensioactifs non ioniques.
• Les tensioactifs ioniques
On distingue trois types de tensioactifs ioniques : les tensioactifs cationiques (chargés positivement), les tensioactifs anioniques (chargés négativement) et les tensioactifs amphotères. Ces tensioactifs sont représentés sur les figures 27, 28 et 29.
Figure 26 – Tensioactif cationique
Figure 27 – Tensioactif anionique
Figure 28 – Tensioactif amphotère
Remarque :
Les tensioactifs cationiques et anioniques sont :
- incompatibles lorsqu'on les mélange (ils forment un complexe insoluble)
- inactifs à un certain pH
Les tensioactifs amphotères ne sont pas utilisés comme émulsifiants mais plutôt comme détergents.
Les tensioactifs ioniques sont rarement utilisés dans les émulsions car la charge du groupement ionique dépend du pH.
• Les tensioactifs non ioniques
Les tensioactifs non ioniques (Figure 29) ne dépendent pas du pH et sont donc les plus utilisés. Ils sont classés généralement en fonction de la nature de la liaison entre la tête hydrophile et la queue hydrophobe.
Figure 29 – Tensioactif non ionique
On distingue trois grands types de tensioactifs :
- les tensioactifs à liaison ester
- les tensioactifs à liaison éther
- les tensioactifs à liaison amide.
Voici quelques exemples de formule générale de tensioactifs :
- les tensioactifs cationiques : R-COO-, X+, exemple : Stéarate de sodium
- les tensioactifs anioniques : R-NH3+, X-, exemple : Sels d'amine
- les tensioactifs non ionique : R-COO-R', exemple : Monostéarate de glycérol
Les tensioactifs sont beaucoup utilisés dans les industries agroalimentaire, cosmétique et pharmaceutique. Le tableau 8 présente quelques exemples de tensioactifs ioniques et non ioniques utilisés comme émulsifiants dans l'industrie.
Famille de tensioactifs | Applications | ||
|---|---|---|---|
Emulsions cosmétiques | Tensioactifs ioniques | Sels alcalins | Stick déodorant, crème à raser, masque à l'argile |
Alkylsulfates | Stick déodorant, dentifrice, shampooing, gel douche | ||
Tensioactifs non ioniques | Ethers de Polyéthylène glycol | Masque | |
Esters de sorbitane | Crème anti-rides | ||
Esters de polusorbate | Mascara, fond de teint | ||
Esters de Polyéthylène glycol | Shampooing | ||
Esters de saccharose | Soin nettoyant, crème de nuit | ||
Emulsions alimentaires | Tensioactifs ioniques | Lécithines | Mayonnaise |
Sels d'acide gras | Gateaux, biscuits | ||
Tensioactifs non ioniques | Monoglycérides (E471) | Chewing-gum, caramels, bonbons | |
Esters d'acide gras et de saccharose (E473) | Glaces, chewing-gum, sucreries, desserts, sauces, soupes | ||
Tristéarate de sorbitane (E492) | Chewing-gum, sucreries, crèmes glacées, desserts | ||
Polysorbate 60 (E435), 65 (E436) | Sucreries, desserts, sauces, chewing-gum, soupes |
Tableau 8 – Exemples de famille de tensioactif ioniques et non ioniques utilisés dans l'industrie
• Propriété physico-chimique des tensioactifs
La méthode, appelée balance hydrophile-lipophile (HLB), développée par William C. Griffin en 1949, permet de chiffrer l'équilibre existant entre la partie hydrophile et la partie lipophile d'un tensioactif. En effet, grâce à cette méthode, les tensioactifs se voient attribuer une valeur de HLB (ou un HLB) variant sur une échelle de 0 à 20, en fonction de l'importance de leur pôle hydrophile par rapport à leur pôle lipophile.
La valeur de HLB étant liée à la solubilité du tensioactif, il est donc possible par une simple observation de mélange de donner une approximation du HLB (Tableau 9).
Observations | HLB |
|---|---|
Deux phases séparées | 1 – 3 |
Mélange grossier | 3 – 6 |
Mélange laiteux peu stable | 6 – 8 |
Mélange laiteux stable | 9 – 10 |
Mélange opalescent | 10 – 13 |
Mélange transparent | > 13 |
Etant donnée que la solubilité permet de déterminer le comportement du tensioactif, il est donc possible de classer les tensioactifs selon leur rôle à partir de leur HLB et ainsi identifier le tensioactif donnant l'émulsion la plus stable.
Le tableau 10 présente les différents rôles que les tensioactifs peuvent jouer en fonction de son HLB.
Valeur du HLB | Rôle |
|---|---|
3 à 6 | Emulsifiants E/H |
7 à 9 | Mouillants |
< 8 | Antimoussants |
8 à 18 | Emulsifiants H/E |
13 à 15 | Détergents |
15 à 18 | Solubilisants |
Les valeurs sont données à titre indicatif et peuvent varier selon les sources.
Ainsi, les tensioactifs amphiphiles possédant un HLB inférieur à 10 sont plutôt lipophiles et les tensioactifs possédant un HLB supérieur à 10 sont plutôt hydrophiles.
Le calcul du HLB n'est jamais effectué par les utilisateurs de tensioactifs car il est toujours indiqué sur les fiches techniques (notices) données par les fournisseurs. Le tableau 11 présente quelques exemples de tensioactifs utilisés dans l'industrie agroalimentaire et cosmétique avec leur valeur HLB.
Tensioactif (nom chimique) | Valeur HLB | Applications |
|---|---|---|
Acide oléique | 1 | Crème soin, fond de teint, spray solaire |
Trioléate de sorbitane | 1,8 | Crème de soin, crème anti-âge |
Monostéarate de sorbitane | 3,8 | Crème de soin, crème anti-âge, déodorant bille |
Lécithine de soja | 8 | Bain moussant, huile capillaire, crème de soin, shampoing |
Monolaurate de sorbitane | 8,6 | Crème de soin, crème anti-âge, déodorant bille |
Trioléate de sorbitane polyoxyéthylène (20) | 10,5 | |
Monooléate de sorbitane polyoxyéthylène (20) | 15 | |
Oléate de potassium | 20 | Shampoing, savon liquide |
• Autres émulsifiants
Il existe beaucoup d'autres émulsifiants tels que les biopolymères amphiphiles, les protéines, ou encore les polyosides. Cependant, ils ne seront pas abordés du fait de leur complexité.
1.4.3 Additifs modificateur de viscosité
Définition : Les additifs modificateurs de viscosité, appelés également agents de texture, sont des molécules qui stabilisent les émulsions en augmentant la viscosité de la phase dispersante.
Il existe des additifs modificateurs de viscosité pour les émulsions de types aqueuses (H/E) et huileuses (E/H).
• Additifs modificateur de viscosité pour les émulsions aqueuse (H/E)
Les agents de textures, stabilisateurs d'émulsion H/E, les plus connus sont les épaississants et les gélifiants. En effet, à faible concentration ils ont la faculté d'augmenter la viscosité de la phase hydrophile.
Ces additifs modificateurs de viscosité peuvent provenir de glucides, de protéines ou de molécules synthétiques. Le tableau 12 présente quelques exemples d'épaississants et de gélifiants utilisés dans l'industrie.
Origine | Exemples | Fonction(s) | Application(s) | |
|---|---|---|---|---|
Glucides | Exsudats de plantes | Gomme arabique | Epaississants/ Gélifiants | Oasis Fraise, Framboise ; Tic Tac Citron Vert/Orange ; Colorants Naturels ; Ferrero. |
Extraits d'algues | Agar-agar, Carraghénanes, Alginates | Epaississants/ Gélifiants | Crèmes fouettées ; crèmes pâtissières ; produits surgelés ; béchamel ; boulettes de viande ; aliments pour animaux ; crème glacées | |
Extraits de graines | Gomme guar | Epaississants | Glace ; pâtisseries | |
Extraits de céréales ou de tubercules | Amidons et amidons modifiés | Epaississants/ Gélifiants | Biscuits ; pâtisseries | |
Extraits de sous-produits végétaux | Pectines | Epaississants/ Gélifiants | Confitures ; gelées ; desserts ; glaces | |
Extraits de micro-organismes | Gomme xanthane | Epaississants/ Gélifiants | Crème de soin, dentifrice ; crème hydratante ; crème anti-rides ; sérum | |
Dérivées de cellulose | Methylcellulose, Carboxyméthylcellulose | Epaississants/ Gélifiants | Masque-gel ; shampoing ; crèmes et laits corporels ; gel coiffant | |
Protéines | Lait | Caséinates | Epaississants/ Gélifiants | Fromages fondus, saucisses, produits laitiers, conditionneur capillaire |
Tissus conjonctifs animaux | Gélatines | Epaississants/ Gélifiants | Anti-rides ; confiseries | |
Molécules synthétiques | Polymères carboxyvinyliques | Epaississants/ Gélifiants | Masques ; gels coiffants | |
Remarques : Des additifs peuvent être à la fois épaississants et gélifiants suivant les conditions d'utilisation (concentration, dissolution). Exemple : le carraghénane (polysaccharide extrait d'algues rouges) est un épaississant dans l'eau froide et un gélifiant dans l'eau chaude.
• Additifs modificateurs de viscosité pour les émulsions huileuses (E/H)
Les additifs modificateurs de viscosité pour les émulsions huileuses sont, en général, d'origine synthétique tels que les silices modifiées, les argiles modifiées ou divers polymères organiques. Les agents de texture pour les émulsions huileuses sont beaucoup plus rares étant donné que la viscosité de la phase huileuse est beaucoup plus importe que celle de la phase aqueuse. Ainsi, pour modifier la viscosité de la phase huileuse, il est conseillé de jouer sur la composition de la phase lipophile de l'émulsion.
Définition : Tension superficielle (milieu dense et gaz)/Tension interfaciale (2 milieux denses)
La tension superficielle est une force existant au niveau de toute interface (surface de contact) entre deux milieux différents. Etant donnée que les molécules préfèrent être entourées par des systèmes ayant la même nature, le système tend à minimiser la surface de contact entre les deux milieux.
On parle de tension superficielle lorsqu'un milieu dense est en contact avec un gaz et on parle de tension interfaciale lorsque deux milieux denses sont en contact.
Définition : Micelle
Agrégat de molécules possédant une tête hydrophile et une queue hydrophobe.
Définition : Amphotère
Qui agit à la fois comme un acide et comme une base : qui peut fournir un ion H+ et capter cet ion.
Définition : Additif
Substance chimique liquide ou solide qui, en général, est introduite avant ou pendant la préparation du produit afin d'apporter ou d'améliorer une ou plusieurs propriétés physico-chimiques.
Définition : Viscosité
Caractérisation de l'aptitude d'un fluide à s'écouler.
Définition : Fraction volumique
Le volume du composant i divisé par la somme des volumes de tous les composants utilisés pour fabriquer ce mélange
Définition : Cellulose
Polysaccharide, constituant essentiel de la membrane cellulaire des végétaux.
Définition : Polymère
Composé macromoléculaire organique ou minéral résultant de la combinaison de plusieurs molécules à partir d'un monomère unique ou de monomères différents.