Structure du noyau : notion de nucléon et d'isotope
Un noyau est constitué de nucléons : les protons et les neutrons (sauf dans le cas du noyau d'hydrogène ne possédant qu'un proton). Dans le cas d'un nucléide
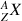 = , Z est le numéro atomique (nombre de protons caractéristique de chaque élément) et N est le nombre de neutrons. Le nombre de masse noté A est défini tel que :
= , Z est le numéro atomique (nombre de protons caractéristique de chaque élément) et N est le nombre de neutrons. Le nombre de masse noté A est défini tel que :
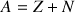 .
.
Les éléments naturels sont caractérisés par un numéro atomique Z compris entre 1 (hydrogène) et 92 (uranium). On peut également produire des éléments artificiels de durée de vie très brève tels que
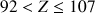 .
.
Exemple :
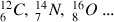
Les isotopes sont des atomes dont les noyaux ont le même nombre de protons Z mais des nombres de neutrons N différents. Les propriétés chimiques d'un élément étant déterminées par le nombre d'électrons, les isotopes sont chimiquement identiques, bien que les masses de leurs noyaux soient différentes.
Exemple :
Le carbone présent dans la nature est composé à environ 98,9% de
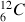 et 1,1% de
et 1,1% de
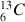
Masse des atomes : la masse des électrons (
 ) étant négligeable devant celles des protons et neutrons (
) étant négligeable devant celles des protons et neutrons (
 ), la masse d'un atome est donc à peu près à un multiple entier de la masse d'un atome d'hydrogène. Compte tenu des masses des protons et neutrons, on exprime généralement la masse d'un isotope en unité de masse atomique (
), la masse d'un atome est donc à peu près à un multiple entier de la masse d'un atome d'hydrogène. Compte tenu des masses des protons et neutrons, on exprime généralement la masse d'un isotope en unité de masse atomique (
 ). Par définition, la masse de l'atome neutre de
). Par définition, la masse de l'atome neutre de
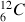 vaut
vaut
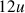 , soit :
, soit :
 .
.
Les masses atomiques apparaissant dans le tableau périodique sont des moyennes pondérées selon les pourcentages relatifs des isotopes de l'élément considéré. Quant au nombre de masse A, c'est la masse atomique exprimée en u, arrondie à la valeur entière la plus proche.
Exemple :
Il existe deux isotopes du chlore de masse
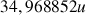 (75,77%) et
(75,77%) et
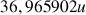 (24,23%). La masse du chlore dans le tableau périodique vaut donc
(24,23%). La masse du chlore dans le tableau périodique vaut donc
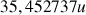 . Son nombre de masse est 35.
. Son nombre de masse est 35.






