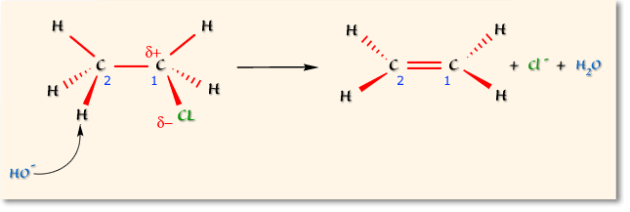
Élimination
Dans le 1-chloroéthane l'électronégativité de l'atome de chlore augmente aussi l'acidité de l'hydrogène porté par le carbone numéroté 2. Cet hydrogène peut subir l'attaque d'une base forte comme l'anion hydroxyle pour conduire à une réaction d'élimination.
Dans ce cas, un anion chlore est également libéré.
Remarque :
Nous venons de voir deux processus réactionnels concurrents favorisés par l'effet inductif. Celui-ci n'est cependant pas suffisant pour rendre compte quantitativement de la compétition entre ces deux réactions, qui dépend de l'évolution de la répartition électronique lorsque l'on passe des réactifs aux produits. Cette évolution affecte les aspects cinétiques et thermodynamiques des deux réactions, qui seront abordés ultérieurement.