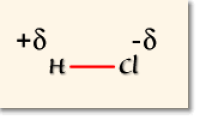Polarisation des liaisons
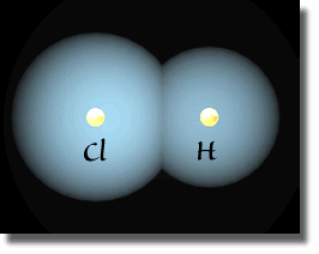
Dans une molécule diatomique homonucléaire (composée d'atomes de même type), le nuage électronique se répartit équitablement sur les deux atomes.
Dans une molécule diatomique hétéronucléaire, l'atome le plus électronégatif polarise le nuage électronique à son profit. La densité de ce nuage dans cette molécule n'est pas égale à la somme des densités atomiques.
Définition : L'électronégativité
L'électronégativité est une grandeur relative qui traduit l'aptitude d'un atome A à attirer à lui le doublet d'électrons qui l'associe à une autre atome B par une liaison covalente.
Dans la classification périodique, l'électronégativité augmente de la gauche vers la droite d'une période (ligne) et du bas vers le haut d'une colonne.
Molécule HCl : somme des densités atomiques et densité réelle
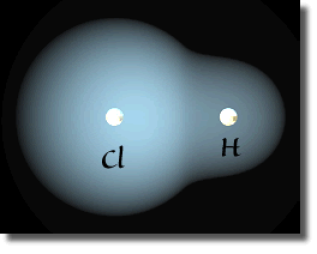
On rationalise ce déplacement du nuage électronique par la notion de charge partielle. L'atome qui s'enrichit d'une portion du nuage électronique porte alors une charge partielle
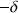 ; l'atome qui s'appauvrit porte une charge partielle positive
; l'atome qui s'appauvrit porte une charge partielle positive
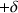 . La charge partielle
. La charge partielle
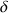 s'exprime en fraction d'électron. Elle est généralement comprise entre 0 et 1.
s'exprime en fraction d'électron. Elle est généralement comprise entre 0 et 1.
Pour faire apparaître simplement cette polarisation de la liaison, on porte les charges partielles sur un schéma étendu. Il vient par exemple pour la molécule de chlorure d'hydrogène
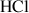 :
: