Variation d'énergie
L'énergie potentielle relative des différentes conformations est donnée par la courbe
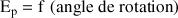 .
.
Celle-ci est d'allure sinusoïdale.
Il existe une barrière d'énergie, évaluée expérimentalement à
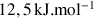 .
.
Pour que les molécules d'éthane d'un échantillon puissent passer d'une conformation à une autre, il faut qu'elles disposent d'une énergie cinétique suffisante. A température ambiante,l'énergie cinétique disponible est d'environ
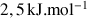 .
.Mais lors de chocs entre molécules, certaines peuvent acquérir une énergie cinétique supérieure à la moyenne et suffisante pour lui permettre de passer la barrière. On donne ci-contre la distribution qualitative des molécules en fonction de leur énergie cinétique, obtenue selon la loi statistique de Boltzmann à une température non nulle.
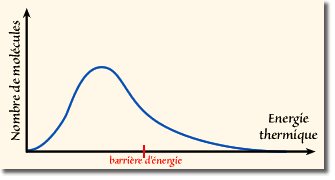
La hauteur de la barrière d'énergie est telle qu'à la température ambiante, la plupart des molécules possèdent une énergie cinétique inférieure à la barrière et leur rotation est empêchée. Mais une fraction non négligeable des molécules possèdent une énergie supérieure leur permettant une rotation complète. On peut ainsi dire que les molécules adoptent des conformations proches de celles correspondant aux minima de l'énergie potentielle : les conformation décalées. Occasionnellement (plusieurs fois par seconde), elles acquièrent assez d'énergie pour franchir la barrière en passant par une conformation éclipsée. On dit dans ce cas que la rotation est une "rotation libre, à crans".
On considère alors que les molécules d'éthane sont en rotation permanente mais qu'elles se trouvent statistiquement le plus souvent dans une conformation proche de celle de plus basse énergie potentielle. On dit que chaque molécule "passe la plupart de son temps" dans la conformation la plus stable, c'est-à-dire la conformation décalée.






