Équation bilan d'une réaction chimique
Une réaction chimique est modélisée par une équation bilan.
Définition : Équation bilan
L'équation bilan d'une réaction chimique est composée de quatre parties :
une simple flèche
 indiquant une transformation de matière totale ou quantitative, c'est-à-dire une transformation de matière allant jusqu'à son maximum (ou une double flèche ⇌ indiquant que le système chimique atteint un état d'équilibre, voir partie acide/base)
indiquant une transformation de matière totale ou quantitative, c'est-à-dire une transformation de matière allant jusqu'à son maximum (ou une double flèche ⇌ indiquant que le système chimique atteint un état d'équilibre, voir partie acide/base)de composés écrits à gauche de la flèche : il s'agit des réactifs
de composés écrits à droite de la flèche : il s'agit des produits

de coefficients entiers (un coefficient avant chaque composé) appelés coefficients stoechiométriques. Grâce à ces coefficients, l'équation-bilan traduit les relations de proportionnalité entre les variations des nombres de moles des différentes espèces mises en jeu.

Dans cette écriture :
les réactifs sont A et B
les produits sont C et D
les coefficients stœchiométriques sont a, b, c et d
Définition : Réactif
Les réactifs sont les composés consommés au cours d'une réaction chimique.
Attention :
Tous les réactifs ne sont pas forcément entièrement consommés au cours de la réaction chimique. La réaction va jusqu'à son maximum si elle est totale (symbole
 ). Maximum ne signifie pas transformation de tous les réactifs
). Maximum ne signifie pas transformation de tous les réactifs
Définition : Produit
Les produits sont les composés formés au cours d'une réaction chimique.
Définition : Réaction chimique
Une réaction chimique traduit les évolutions (consommation) des réactifs et des produits (formation).
Définition : Coefficient stœchiométrique
Les coefficients stœchiométriques sont généralement des nombres entiers indiquant l'évolution du nombre de moles des réactifs et l'évolution du nombre de moles des produits.
L'équation

signifie que
 moles de
moles de
 disparaissent en même temps que
disparaissent en même temps que
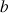 moles de
moles de
 pour former
pour former
 moles de
moles de
 et
et
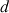 moles de
moles de
 . La description de cette évolution est la même quelle que soit la composition initiale du mélange réactionnel.
. La description de cette évolution est la même quelle que soit la composition initiale du mélange réactionnel.
Transformation totale ou état d'équilibre
Dans le cas d'une transformation totale au moins un des deux réactifs (A et/ou B) est consommé et on écrit la réaction chimique avec une simple flèche

aA + bB
 cC + dD
cC + dD
Dans le cas où la réaction atteint un état d'équilibre tous les produits et les réactifs restent présents. La réaction chimique se fait dans les deux sens (de la gauche vers la droite et de la droite vers la gauche) et quand l'équilibre est atteint les quantités de matière des produits et des réactifs restent constantes. On écrit la réaction chimique avec une double flèche ⇌
aA + bB ⇌ cC + d






