Le diagramme de Jablonski : correspondance entre maximum d'absorption des pigments et transition électronique
Vous avez appris au cours de chimie et/ou de physique que les niveaux énergétiques (ou orbitales) des atomes et des molécules sont quantifiés. Au repos, les électrons périphériques se trouvent sur le niveau d'énergie le plus bas (notés “Ground level” dans la figure 20a). C'est l'état le plus stable. Les propriétés de cet état sont très largement méconnues puisque pour l'étudier, il faut utiliser de l'énergie, et donc le perturber.
Les électrons périphériques sont propulsés vers un niveau supérieur, appelé niveau d'excitation, lorsque de l'énergie est apportée. Dans le cas des pigments, l'énergie est associée aux photons. Donc, l'illumination de la chlorophylle en solution excite la molécule. Les électrons excités sont propulsés dans un niveau d'excitation lorsque l'énergie apportée correspond exactement à la différence d'énergie qui sépare le niveau fondamental et ce niveau d'excitation. C'est ce que l'on appelle une transition électronique. Pour la molécule de chlorophylle, on reconnaît deux niveaux d'excitation principaux appelés premier et second état d'excitation (notés “1st excited state” et “2nd excited state” dans la figure 20a). La différence d'énergie entre chacun de ces niveaux et l'état fondamental correspond exactement à l'énergie nécessaire pour promouvoir un électron périphérique de l'état fondamental sur l'un de ces niveaux. Cette énergie étant délivrée sous forme de photons, la promotion d'un électron périphérique sur un des deux états d'excitation correspond à l'absorption du photon. Les niveaux d'excitation correspondent donc aux bandes d'absorbance du pigment. Comme nous l'attendons, le spectre d'absorbance de la chlorophylle a présente donc deux bandes d'absorbance. La première, de basse énergie, est située dans la partie rouge du spectre visible vers 663 nm tandis que la seconde, de haute énergie, est située dans la partie bleue du spectre visible vers 435 nm (Figure 20b). Il est important de bien réaliser que la molécule reste électriquement neutre dans ce cas. L'énergie séparant ces deux niveaux est donc reflétée par la position de la bande d'absorption dans le spectre d'absorbance du pigment. La durée de la transition est de l'ordre de 10-15 s.
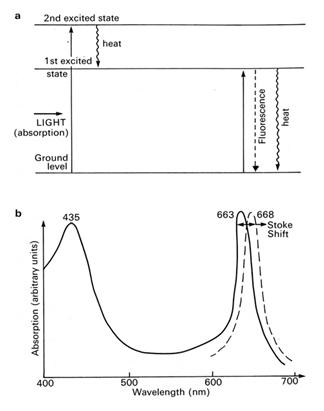
Les niveaux énergétiques d'une molécule sont quantifiés. Au repos, les électrons périphériques se trouvent dans l'état le plus stable, c'est-à-dire sur le niveau de plus basse énergie (ground level, panneau a). L'absorption de photons rouges (663 nm) propulse les électrons dans le premier état d'excitation tandis que l'absorption de photons bleus (435 nm) propulse les électrons dans le second état d'excitation (trait continu dans le panneau b).
Lorsque les électrons quittent le premier état excité, ils rendent à l'environnement la majorité de l'énergie absorbée sous forme de fluorescence ou de chaleur. Les électrons qui se trouvent dans le second état d'excitation ne peuvent retourner à l'état fondamental qu'en passant par le premier état d'excitation. L'énergie correspondant à la transition entre ces deux états d'excitation s'accompagne par l'émission de chaleur. Le spectre d'émission de la fluorescence de la chlorophylle ne présente donc qu'une seule bande située à 688 nm (trait interrompu dans le panneau b). Ce décalage vers les grandes longueurs d'onde est appelé le déplacement de Stokes. Il correspond à l'énergie qui est dissipée sous forme de chaleur à l'intérieur du premier niveau d'excitation.