Le Golgi, un lieu de maturation et de tri des protéines
Les protéines ayant été modifiées et repliées, le REr doit faire face à la redoutable tâche de les trier : en retenir le plus grand nombre destiné à s'occuper de la nouvelle vague de protéines synthétisées et diriger les autres vers le Golgi. Les transports de protéines (et de lipides) du REr vers les autres organites (Golgi, lysosome, granules de sécrétion et membrane) se fait par des vésicules, conteneurs limités par une membrane lipidique et dont le contenu est nommé « charge ». Le terme charge désigne aussi bien les protéines (et lipides) destinées aux autres compartiments que les enzymes de modification qui les accompagnent transitoirement. Ce mode de transport est caractérisé par une série d'événements orchestrés par des protéines liant le GTP (Arf1, Rab1, Sar1). Ces protéines sont responsables de recrutement des récepteurs (pour sélectionner la charge), des protéines de manteau (formation d'un bourgeon) et des protéines impliquées dans le processus de fission (séparation d'une vésicule de transport du REr) et de fusion (fusionnement des vésicules).
A partir du REr se constitue un flux important de nombreuses vésicules chargées des protéines nouvellement synthétisées ainsi que des d'enzymes de modification qui les accompagnent ( parfois des chaperonnes) et de toute la machinerie nécessaire à la fission et la fusion des vésicules. Selon le modèle actuellement admis, les citernes de l'appareil de Golgi se déplaceraient progressivement à partir du réseau cis-golgien jusqu'au réseau trans-golgien et, les enzymes d'accompagnement, la machinerie de fusion et les protéines chaperonnes seraient recyclées par un contre-courant (transport rétrograde) de vésicules qui retournent soit vers des citernes du Golgi plus en amont soit vers le RER.
Dans l'appareil de Golgi la composition des lipides et celle des glycoprotéines sont remaniées. Nous nous focalisons ici sur les modifications de protéines (post-traductionnelles), au cours d' un certain nombre de processus que l'on groupe sous le nom de "maturation". Tout d'abord la cupule glucidique est ajustée par la mannosidase-2 et une nouvelle variété de sucres (galactose, fucose, N-acétylglucosamine, acide sialique et autres) est ajoutée par différentes glycosyl-transférases. De cette façon, des chaînes de polysaccharides complexes sont construites, donnant naissance à des glycoprotéines complexes. Rappelons que ce qui est à l'intérieur de l'appareil de Golgi sera libéré lors de la fusion de vésicules golgiennes avec la membrane plasmique. Pour ce qui est des protéines destinées au lysosome, un des mannoses est phosphorylé pour donner naissance au mannose-6-phosphate qui servira d'étiquette pour la sélection dans le réseau trans-golgien (rôle comparable à celui d'un peptide de destination).
Une fois arrivées au réseau trans-golgien, les protéines sont à nouveau triées (sélectionnées) par des récepteurs spécifiques, associés aux protéines du manteau. Celles-ci font en sorte qu'elles sont dirigées vers le bon compartiment subcellulaire (lysosome, vésicule de sécrétion ou membrane plasmique). Enfin, à la fois dans les lysosomes et le réseau trans-golgien, les protéines précurseurs sont partiellement hydrolysées (clivage) par des protéases appelées subtilisines (furine et pro-protéine convertases). Celles-ci jouent un rôle dans l'activation des enzymes et dans la bonne configuration de récepteurs, d'hormones ou de neuropeptides (dont certains ne sont constitués que de quelques acides aminés).
Pour plus de détail sur la glycosylation complexe des protéines et le mannose-6-phosphate, voir la section 8.7 « la glycosylation dans le Golgi ».
Pour plus de détail sur le récepteur du mannose-6-phosphate, voir chapitre 9, la section « Vers le lysosome primaire grâce au récepteur du mannose-6-phosphate ».
Pour plus de détail sur la protéolyse partielle (clivage) des protéines précurseurs (pro-hormone, pro-enzyme, etc) voire le chapitre 9, section « vers la voie de la sécrétion contrôlée ».
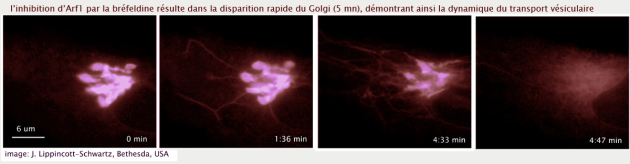
Le blocage de la maturation des vésicules ERGIC responsables de la formation des citernes cis golgiennes, conduit presque instantanément à la disparition de l'appareil de Golgi, démontrant ainsi que le golgi n'existe que grâce à un flux constant de vésicules qui entrent dans l'organite (ERGIC / cis-Golgi) et sortent à l'autre extrémité (trans-Golgi) (voir figure 22).
Dans les trois sections suivantes (8.4, 8.5 et 8.6), nous décrirons en détails les grandes lignes des événements moléculaires responsables du transport vésiculaire. Cette description ne se limite pas au passage entre REr et Golgi. Le sujet est très compliqué et considéré trop détaillé pour les étudiants en premier année (introduction à la biologie cellulaire).