Le peptide signal induit le passage vers le REr : acheminement co-traductionnel
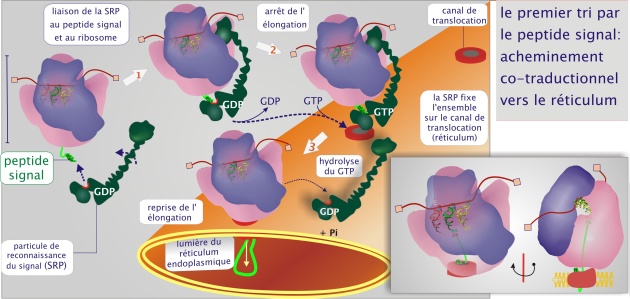
Le premier tri est réalisé par un récepteur qui reconnaît le peptide signal. On le qualifie de « particule de reconnaissance du signal » (SRP), composée de protéines (six chaînes polypeptidiques, chacune nommée d'après sa masse moléculaire ; SRP 9, 14, 19, 54, 68, 72), d'ARN (ARN 7S de 300 nucléotides) et de GTP. Cette particule se fixe à la fois au peptide signal (liaison récepteur-ligand) et au ribosome duquel le peptide signal émerge (voir figure 3). L'ensemble SRP / ribosome est ensuite recruté sur la surface du réticulum endoplasmique par un récepteur membranaire, le récepteur du SRP, lui-même lié au canal de translocation (PCC). Au cours de cet événement la synthèse de la protéine est suspendue car le SRP bloque l'accès des facteurs d'élongation, eEF–1 et eEF–2 (et ceci évite que la protéine destinée au REr ne soit libérée dans le cytoplasme). Ce recrutement est suivi par une hydrolyse du GTP, en GDP et Pi, qui libère la particule SRP.
pour plus de détail sur la structure de la SRP.
pour plus de détail sur la fixation de la SRP sur le canal de translocation.
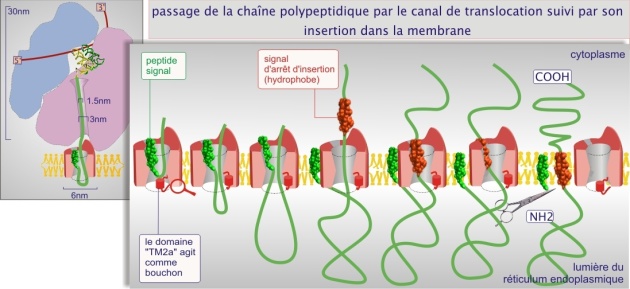
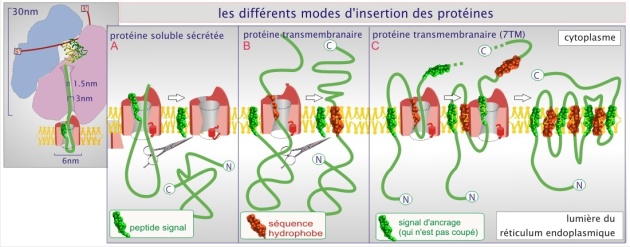
Le canal de translocation, constitué de plusieurs protéines dont le Sec61p, fixe ensuite le « peptide signal ». La protéine naissante, au fur et à mesure de sa croissance, empruntera le canal pour passer entièrement dans la lumière du réticulum (protéine sécrétée) ou pour progressivement être intégrée à la membrane (protéine transmembranaire) (voir figures 4 et 5). La nature hydrophobe du peptide signal (hélice–\(\alpha\)) permet également une interaction avec les phospholipides de la membrane.
Pendant la translocation, le canal (qui forme un pore d'environ 4 nm de diamètre) ne laisse pas passer les solutés. Après la translocation, le canal se ferme. Lors de la synthèse de protéines sécrétoires, les protéines destinées à la lumière du REr, du Golgi ou du lysosome, le peptide signal est excisé par une peptidase liée au canal de translocation (voir figure 5 et cliquez sur les loupes pour des exemples précis qui concernent l'insuline, le récepteur de l'EGF et la rhodopsine). Pour les protéines transmembranaire, deux options se présentent : les protéines transmembranaires dont le C–terminal est intracellulaire et le N–terminal extracellulaire perdent leur peptide signal. Pour les autres, le peptide signal est préservé et persiste sous forme d'hélice–\(\alpha\) comme site d'insertion dans la membrane.
L'entrée de la chaîne polypeptidique dans le REr ne se fait que lorsqu'elle compte au moins 70 acides aminés (40 se trouvant encore dans le ribosome et 30 transitant par le canal de translocation).
pour plus de détail sur l'insuline humaine, protéine sécrétée.
pour plus de détail sur le récepteur de l'EGF, protéine transmembranaire.
pour plus de détail sur la rhodopsine bovine, protéine transmembranaire.
![]() Pour en savoir plus, consultez le document suivant : « protein conducting channel » [pdf] (502 Ko), Bert Van Den Berg
Pour en savoir plus, consultez le document suivant : « protein conducting channel » [pdf] (502 Ko), Bert Van Den Berg
Remarque : L'hypothèse du « signal »
Elle a été énoncée en 1971 par Günter Blobel (Laboratory of Cell Biology, Rockefeller University, New York) qui s'interrogeait sur la façon dont les protéines destinées à sortir de la cellule étaient d'abord dirigées vers le réticulum endoplasmique. Il s'appuyait sur les travaux de biochimie et microscopie électronique, effectués par le groupe de George Palade (dans le même laboratoire), qui avaient montré en détail comment les protéines nouvellement synthétisées traversent successivement le réticulum endoplasmique rugueux et le Golgi pour arriver dans les vésicules de sécrétion, les lysosomes ou la membrane cytoplasmique. Blobel a démontré que ces protéines portaient un signal intrinsèque qui leur permettait d'atteindre la membrane du réticulum et de la traverser : c'est l'hypothèse du signal. Le mécanisme est universel car il fut retrouvé aussi bien chez la levure, que chez les végétaux et les animaux. Pour ses travaux, Blobel a été récompensé en 1999 par le prix Nobel de Physiologie et Médecine.
Pour plus d'information sur le lauréat du Prix Nobel cliquez ici http://www.nobelprize.org/nobel_prizes/medicine/laureates/1999/