L'actine
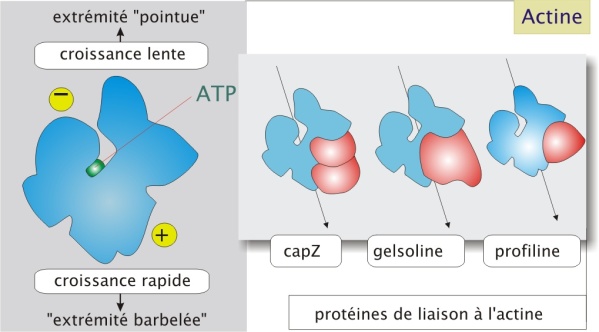
Dans de nombreuses cellules animales c'est la protéine la plus abondante (5% au moins de la masse protéique totale). Les filaments d'actine forment des structures dynamiques rendues plus au moins stables par des protéines associées. Par exemple les formes stabilisées se rencontrent dans les microvillosités et les cellules musculaires. L'actine, codée par six gènes au moins, est une protéine liée à l'ATP, ayant un pôle plus et un pôle moins, et d'un poids moléculaire d'environ 43 kDa (figure 1 ci-dessous).
On distingue trois classes :
\(\alpha\)actine que l'on trouve dans les cellules musculaires (aussi bien striées que lisses),
\(\beta\)actine (quatre formes) et
\(\lambda\)actine.
Ces deux dernières classes se trouvent dans les cellules non musculaires. La diversité moléculaire entre les six types d'actine est très faible puisqu'on relève plus de 90% d'identité dans leur séquence d'acides aminés. La partie variable concerne les 30 acides aminés du coté amino-terminal (sur un total de 375 résidus).
Des protéines dites de liaison qui, comme on le verra ci-dessous, jouent un rôle important dans la polymérisation et la stabilisation des filaments d'actine, peuvent aussi permettre de coupler les filaments entre eux et d'engendrer le mouvement (voir interaction avec la myosine-II).