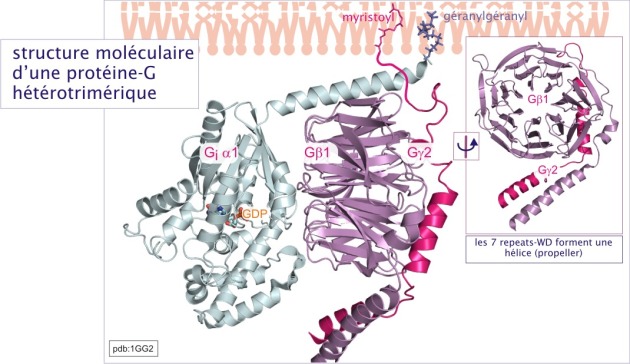
Protéines G hétérotrimériques
Les protéines-G hétérotrimériques furent les premières protéines-G identifiées, d'abord à propos de la phototransduction visuelle, puis de l'activation \(\beta-\)adrénergique. Sur la base de ces études, le principe du cycle des GTPases, comme décrit ci-dessus, fut posé. Les protéines-G hétérotrimériques constituent un complexe de trois sous unités : G\(\alpha\)(39-45kDa), G\(\beta\)(32 kDa) et G\(\gamma\)(8 kDa).
- La sous-unité G\(\alpha\) fixe le guanine nucléotide. Elle est constituée d'une poche de liaison nucléotidique (domaine « rd »), identique à celle de Ras, avec un domaine additionnel consistant en un faisceau d'hélices- (domaine « hd ») qui recouvre la poche de liaison de GTP. La sous-unité G\(\alpha\) joue un rôle majeur dans l'interaction avec les effecteurs en aval tels que l'adénylyl ou la guanylyl cyclase, la GMPc-phosphodiestérase, la phospholipase-C\(\beta\) , RhoGEFs ou les canaux K+. Le domaine « hd » longtemps demeuré énigmatique est maintenant considéré, dans le cas de G\(\alpha_T\) (transducine), comme jouant un rôle dans l'interaction avec son effecteur GMPc-phosphodiestérase (rôle d'un modulateur allostérique) (voire figure 26).
- La sous unité \(-\beta\) est caractérisée par sept feuillet \(-\beta\) antiparallèles, appelés WD-repeats, car les séquences d'environ 35 acides aminés du « repeat » se terminent souvent par tryptophane (W) et asparatate (D). L'ensemble des repeats-WD forme une hélice, structure impliquée dans les interactions protéine-protéine. Nous avons déjà rencontré cette structure lors de l'évocation du récepteur \(\beta\)-Trcp1de la ligase SCF et dans celle de . La face dorsale de l'hélice interagit avec la sous-unité G\(\gamma\) par une liaison quasiment indissociable, alors que sa face frontale interagit avec la sous-unité G\(\alpha\), par une liaison dépendant de l'état de G\(\alpha\) (liée au GDP ou au GTP).
- La sous-unité \(-\gamma\) est une petite chaîne de 72 acides aminés dont 54 constituent le motif GGL (G protein Gamma subunit-like motifs). Complexée à la sous unité \(\beta\) (complexe \(\beta \gamma\)), elle interagit également avec des effecteurs, tels que les canaux K+ du cœur, la phospholipase-A2 et certaines isoformes de phospholipase-C\(\beta\).
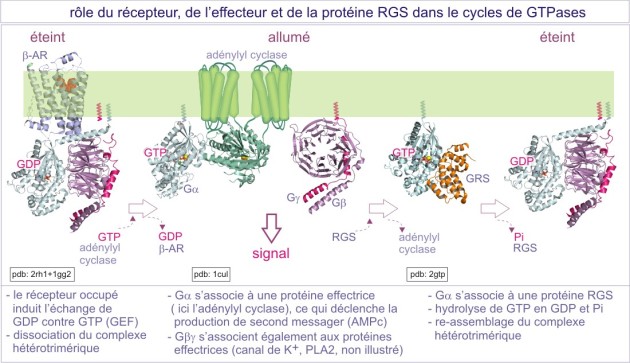
La protéine-G trimérique est liée à la membrane par des queues lipidiques : myristoyl ou palmitoyl (acides gras) pour le G\(\alpha\) et farnésyl ou géranylgéranyl (isoprénoïdes) pour le G\(\gamma\). Elle interagit exclusivement avec une classe de récepteurs à sept domaines transmembranaires, qui, pour cela, sont nommés G-Protein Coupled Receptors (GPCRs). Les caractéristiques du cycle GTPasique de la sous-unité G\(\alpha\) sont comparables à ceux des protéines monomériques, sauf que leur activité GTPasique intrinsèque est plus forte en raison de la présence d'une arginine en position 201 (cible de la cholératoxine). C'est la fixation du ligand aux récepteurs à sept domaines transmembranaires, qui favorise l'échange entre GDP et GTP (les récepteurs jouent donc le rôle d'un GEF). L'activité GTPasique est stimulée soit par la liaison des effecteurs de la cascade de signalisation en aval (rétrocontrôle négatif dans lequel les effecteurs jouent le rôle de GAP), soit par les protéines RGS (regulators of G-protein signalling). Des études récentes montrent que certaines protéines RGS agissent aussi comme effecteurs, en aval du récepteur. Par exemple, p115Rho-GEF, qu'on classe parmi des protéines RGS est capable d'activer la GTPase monomérique RhoA. D'autres protéines RGS peuvent agir comme des protéines d'amarrage, en recrutant des effecteurs participant au complexe récepteur.
Il faut noter que le récepteur peut interagir successivement avec plusieurs protéines-G. En effet, l'interaction entre récepteur « activé » et protéine-G est interrompue lorsque G\(\alpha\) est chargé en GTP. Le récepteur libéré peut alors recruter d'autres protéines-G dans leur état GDP. La liaison de GTP affaiblit également l'interaction entre G\(\alpha\) et G\(\beta \gamma\) et le complexe peut se dissocier. Le G\(\alpha\) et le G\(\beta \gamma\) ainsi libérés interagissent avec des molécules effectrices (voir figure 27). Les sous-unités de protéines G hétérotrimériques existent sous différentes formes (à ce jour, 16 G\(\alpha\), 6 G\(\beta\) et 12 G\(\gamma\)) qui permettent théoriquement de nombreuses combinaisons. Pour une cellule donnée, ce nombre demeure toutefois limité (voir figure 27 pour quelques exemples).
Remarque :
Les sous unités-\(\alpha\) déterminent la diversité des protéines G.
La plupart des cellules animales expriment environ 9 des 16 sous unités G\(\alpha\) connues. Quelques unes des sous unités, telles que G\(\alpha_t\), G\(\alpha_ {olf}\) ou G\(\alpha_ {gust}\), sont exprimées seulement dans un type spécifique de cellule sensorielle (respectivement, le photorécepteur rétinien, la cellule sensorielle olfactive et les récepteurs du goût). D'autres sont présentes dans des cellules qui ont une origine embryonnaire commune. Ainsi, G\(\alpha_o\) est exprimée dans les cellules qui dérivent de la crête neurale comme les cellules endocrines du tube digestif, du pancréas et de l'hypophyse. G\(\alpha z\) est la sous-unité qui prédomine dans les neurones et G\(\alpha 16\) n'est exprimée que dans les cellules d'origine hématopoiétique. G\(\alpha q\) , G\(\alpha i1\) ou G\(\alpha i3\) sont présentes dans la majorité des cellules et G\(\alpha s\), G\(\alpha i2\), G\(\alpha i3\), et sont universellement exprimées. La totalité des combinaisons physiologiques des trois sous unités n'est pas connue.
Remarque : Quelques chiffres pour illustrer la dimension des choses.
Il faut 140 secondes à la GTPase monomérique Ras pour hydrolyser la moitié de son GTP total alors qu'il n'en faut que 20 à une GTPase hétérotrimérique pour réaliser la même performance. En revanche, les deux types de GTPases ont besoin en moyenne de 30 minutes pour remplacer leur GDP par GTP (réaction d'échange). Cependant, l'activation du récepteur permet de réduire à une seconde ce temps d'échange.
Les protéines-G et leurs récepteurs associés (GPCR) ont donné lieu à deux prix Nobel :
![]() Pour en savoir plus consulter leur discours Nobel :
Pour en savoir plus consulter leur discours Nobel :
« G-proteins Nobel Rodbell lecture [pdf] » (140 ko).
« G-proteins Nobel Gilman lecture [pdf] » (100 ko).
En 2012, le prix de Chimie, attribué à Robert Lefkowitz et Brian Kobilka.
Pour en savoir plus cliquez ici.
![]() Pour en savoir plus sur les protéines RGS :
Pour en savoir plus sur les protéines RGS :
« RGS proteins Chidiac [pdf] » (544 ko).
« G-proteins GAP GEF GDI Willard [pdf] » (2,23 Mo).
Complément : Excursion 9 : Les protéines-G hétérométriques sont des cibles pour les toxines bactériennes.
Vibrio cholerae est une bactérie qui entre dans le système digestif, par voie orale, et cause une diarrhée sévère due à une perte massive de Cl - par la muqueuse intestinale (l'eau suit les ions) causant la mort par déshydratation. La base moléculaire de cette pathologie repose sur la catalyse, par l'exotoxine cholérique, du transfert d'un ADP-ribose du NAD sur l'arginine 201, acide aminé nécessaire à l'activité GTPasique. Une des conséquences de cette modification est la prolongation du temps d'activation de G\(\alpha\)s, ce qui se traduit par une stimulation prolongée de l'adénylate cyclase et donc un niveau très élevé de l'AMPcyclique (AMPc). Le lien entre l'augmentation d'AMPc et la dérégulation du transport de Cl - n'est pas encore établi. Le haut niveau de l'AMPc ne semble pas en être la cause essentielle car l'inhibition de l'AMPc-phosphodiestérase ou l'introduction d'un analogue de l'AMPc (dibutyryl-AMPc) n'induisent pas la pathologie.
Bordetella pertussis est une bactérie qui entre dans le corps par l'épithélium respiratoire et se répand dans d'autres tissus, causant ainsi la « coqueluche ». Le symptôme clinique consiste en crises paroxystiques (convulsions), qui se manifestent dans le dernier stade de l'infection. Cette pathologie est due à l'exotoxine pertussique, qui catalyse le transfert d'un ADP-ribose du NAD sur la cystéine-347 de G\(\alpha\)i (ou d'un résidu équivalent dans d'autres sous-unités G\(\alpha\)). Cette modification inhibe l'interaction de la protéine G-trimérique avec son récepteur associé. Elle garde la sous-unité G\(\alpha\) (qui normalement inhibe l'adénylate cyclase) dans sa forme inactive liée au GDP, provoquant ainsi une augmentation des niveaux d'AMPc dans des cellules diverses telles que les cellules des îlots de Langerhans du pancréas (d'où sa première appellation « islet activating factor »), les lymphocytes, les leucocytes, les myocytes cardiaques et d'autres cellules encore mal identifiées mais probablement responsables des crises paroxystiques (cellules nerveuses ?). La toxine tue la cellule, créant ainsi de véritables trous dans les tissus. C'est pourquoi la bactérie a été qualifiée de « pertussis », qui signifie « trou » en latin et qui en français, a donné pertuis.
Clostridium botulinum produit entre autres toxines, la toxine C3 qui catalyse le transfert d'un ADP-ribose du NAD sur l'asparagine-41 de la RhoGTPase. Cette GTPase est impliquée dans différents processus cellulaires dont la régulation du cytosquelette (qui a été particulièrement étudiée), la synthèse protéique et la signalisation cellulaire. La contribution de la toxine C3 à la maladie (parmi d'autres toxines produites) n'est pas encore totalement documentée. Les premiers symptômes caractéristiques du botulisme sont une asthénie marquée, une sensation de faiblesse et des vertiges. Les troubles visuels, la sécheresse buccale et les troubles de l'élocution et de la déglutition apparaissent ensuite. La maladie évolue vers une faiblesse du cou, des bras et des muscles respiratoires, qui rend la respiration difficile .
Complément : Excursion 10 : Rhodopsine et phototransduction (Pascal Branchereau).
La vision est la modalité sensorielle ayant le plus évolué au cours de la phylogenèse. Elle représente chez l'homme le système sensoriel le plus développé. Ainsi, sur les 3 millions de fibres sensorielles répertoriées chez l'homme, 2 millions sont issues des yeux.
La fonction visuelle consiste à déduire, à partir des images rétiniennes, une représentation tridimensionnelle du monde extérieur. Ceci est rendu possible grâce à l'œil, récepteur biologique de la lumière (radiation électromagnétique visible) et donc des images. Ce système optique qui a souvent été comparé à un appareil photographique est composé d'un diaphragme (pupille), d'un système de lentilles (cornée, humeur aqueuse, cristallin, humeur vitrée), et d'une pellicule (rétine). La rétine est formée d'un réseau de cellules organisées en couche, la couche la plus externe étant composée des photorécepteurs . Ceux-ci sont de deux types : les cônes qui sont activés par des stimuli de forte intensité (lumière du jour, condition photopique) permettent la vision des couleurs alors que les bâtonnets sont capables de détecter des stimuli de très faible intensité (condition scotopique). La sensibilité des bâtonnets est extraordinaire : les travaux de Hecht et al. (1942) impliquant des sujets humains ont permis d'estimer qu'un bâtonnet peut être excité par un simple photon et que l'excitation de 5 bâtonnets par un photon peut engendrer une sensation visuelle. Des enregistrements électrophysiologiques in vitro de bâtonnets ont confirmé la sensibilité quantique des photorécepteurs : un courant (positif) proportionnel à l'intensité lumineuse est enregistré lors de l'illumination d'un bâtonnet (voir figure E17A) et lorsque des flashes de très faible intensité (condition scotopique) sont appliqués le courant fluctue de manière quantique.
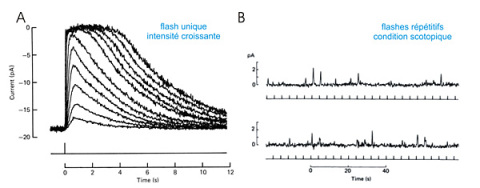
Figure E17 : Détection de la lumière par un bâtonnet de crapaud Bufo marinus .
A : réponses à un flash d'intensité croissante. Le flash (appliqué au temps t=0s) évoque un courant transitoire dont l'amplitude augmente pour atteindre une intensité saturante (longueur d'onde 50nm, durée du flash 20 ms). D'après Hodgkin et al. J. Physiol. 1984.
B : réponses quantiques d'un seul bâtonnet de singe Macaca fascicularis à des flashes (traits verticaux sous les tracés) en condition scotopique. L'amplitude du courant unitaire de 0,7pA correspond à la détection d'un seul photon.
D'après Baylor et al. J. Physiol. 1984. Enregistrements de courant (pA) obtenus en configuration voltage imposé.
Au sein des cônes et des bâtonnets, c'est un mécanisme de phototransduction qui permet la conversion de l'énergie lumineuse en message nerveux, ceci grâce à l'utilisation de pigments rétiniens localisés sur la membrane des disques du segment externe des photorécepteurs (voir figure E18).
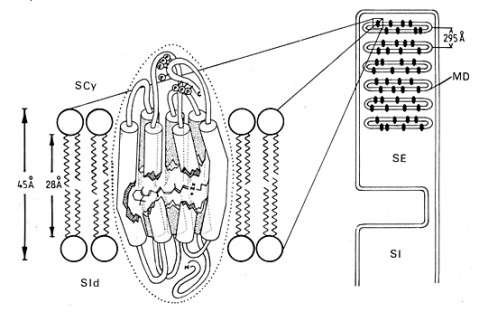
Figure E18 : Localisation du pigment rétinien au niveau de la membrane des disques du segment externe du photorécepteur. A gauche : molécule de rhodopsine composée de l'opsine, 7 hélices a et du chromophore, le 11- cis -rétinal, au centre. La partie N terminale glycosylée de l'opsine est présente au niveau de la face interne du disque (surface intradiscale, SId) alors que la partie C terminale qui possède plusieurs sites de phosphorylation (P) émerge sur la face cytoplasmique du segment externe (surface cytoplasmique, SCy). A droite : une coupe longitudinale de bâtonnet avec les disques et leur membrane (MD). SE : segment externe ; SI : segment interne.
D'après Pierre Buser et Michel Imbert, Vision, Herman, Paris.
Le mécanisme de phototransduction au sein des cônes est très similaire à celui rencontré dans les bâtonnets même si il diffère en termes de spécificité des couleurs. Le pigment rétinien des bâtonnets est la rhodospine (Rh) alors qu'il existe trois types de pigments au niveau des cônes et ainsi trois types de cônes selon leur maximum de sensibilité (bleu 420 nm, vert 530 nm et rouge 560 nm). Ces trois pigments sont, comme la rhodopsine, composés d'une molécule sensible à la lumière appelée chromophore, le 11- cis -rétinal , qui est inséré par une liaison covalente à une protéine à 7 segments transmembranaires insensible à la lumière, l'opsine (figure E18). C'est au niveau de l'opsine qu'on trouvera les différences entre les 3 pigments des cônes et celui des bâtonnets : pour les cônes on parle d'iodopsine S (Short wavelenght pour les cônes bleus), M (Middle wavelenght pour les cônes verts) et L (long wavelenght pour les cônes rouges), alors que pour les bâtonnets, on parle de rhodopsine. Nous allons maintenant aborder les mécanismes moléculaires sous-tendant la phototransduction au niveau des bâtonnets.
Au niveau du chromophore, la lumière induit, par une isomérisation, le passage cis à la forme tout- trans (forme la plus stable) du rétinal. Ce passage qui se fait en 10 -4 s induit le déplacement de la jonction opsine-chromophore. Dès lors s'ensuit une série de réactions chimiques (12 étapes) qui aboutissent à la formation de métarhodopsine II ou rhodopsine photoactivée (Rh*) et à une séparation de l'opsine et du chromophore (après quelques millisecondes). Ce dernier sous sa forme tout- trans -rétinal diffuse hors du photorécepteur pour être régénéré en cis -rétinal (le tout en environ 1 h).
Nous avons vu que le signal lumineux capable d'activer le photorécepteur est très faible. Aussi, il faut un système d'amplification. Entre 1964 et 1967, les premières mesures électrophysiologiques intracellulaires réalisées sur des bâtonnets de vertébrés ont montré qu'à l'obscurité le récepteur est dépolarisé (en voltage imposé, on enregistre un courant entrant permanent, environ 17pA sur la figure E 17A) et que la lumière hyperpolarise le récepteur (le courant entrant se ferme et on atteint le niveau 0 courant si l'intensité du flash est saturante, cf. figure E17A) (1). Il est important de noter que cette réponse diffère des réponses dépolarisantes que l'on rencontre dans le reste du système nerveux central lorsqu'un neurone est activé.
A l'obscurité, c'est un courant entrant permanent de cations (Na+ et Ca2+) affectant uniquement le segment externe du photorécepteur qui est responsable de la dépolarisation du potentiel de membrane du photorécepteur. Il y a donc ouverture d'un canal cationique à l'obscurité : canal que l'on peut qualifier de lumière sensible. Ces canaux lumière sensibles vont se refermer en présence de lumière et entraîner une hyperpolarisation car les canaux de fuite restent actifs au niveau du segment interne engendrant une sortie de cations et ainsi une hyperpolarisation (voir figure E19).
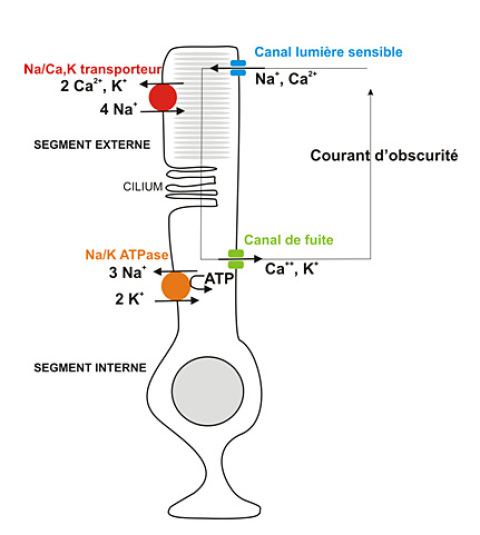
Figure E19 : Principaux mouvements cationiques à travers la membrane plasmique d'un bâtonnet à l'obscurité. Une boucle de courant correspondant à l'entrée de cations au niveau du segment externe par les canaux lumière sensibles et à la sortie de cations au niveau de canaux de fuite localisés sur le segment interne est responsable du courant d'obscurité.
Le fait que la rhodopsine soit située sur les disques alors que les canaux cationiques sont au niveau de la membrane plasmique du segment externe indique qu'il existe un mécanisme intracellulaire qui assure la liaison entre les deux : c'est un mécanisme de second messager impliquant le guanosine-3'-5'-monophosphate cyclique ou cGMP . C'est en effet le cGMP qui est capable d'ouvrir directement les canaux cationiques lumière-sensibles du segment externe.
Voyons comment l'activation de la rhodopsine par la lumière modifie la concentration de cGMP et donc l'ouverture/fermeture des canaux lumière-sensibles. Lors d'une illumination l'activité de la phosphodiesterase (PDE6A) augmente ce qui entraîne une chute de la concentration intracellulaire en cGMP ([cGMP]i) car la PDE6A hydrolyse le cGMP en 5'-GMP. Cette augmentation est due à la transducine (GNAT1) qui est une protéine G (on l'appelle G T ) composée de 3 sous-unité : a T , b T et g T. Lors d'une illumination, R* active la sous-unité a T préalablement liée à du guanosine diphosphate (GDP) et entraîne l'échange du GDP avec du guanosine triphosphate (GTP) et ainsi la formation de a T -GTP. Ce dernier se sépare des sous-unités b T et g T et active la PDE qui hydrolyse le cGMP en 5'GMP et conduit à la fermeture des canaux d'obscurité.
En sachant qu'un seul photon peut entraîner la fermeture de 3% des canaux ouverts dans l'obscurité, on peut penser que même une illumination modérée doit être capable de d'engendrer la fermeture de tous les canaux lumière-sensibles. Ainsi, un phénomène de saturation doit rapidement s'installer en présence de lumière. Cependant, l'œil humain est capable de détecter des différences d'intensité lumineuse, même en présence d'une lumière ambiante d'intensité élevée. Il doit donc exister un mécanisme d'adaptation qui réduit l'amplification de telle sorte qu'il existe toujours des canaux ouverts lorsque l'éclairement de fond est élevé. Une composante importante des mécanismes d'adaptation à travers laquelle la sensibilité est ajustée en fonction de la lumière ambiante repose sur l'activité GTPasique de la sous-unité a T de la transducine qui hydrolyse le GTP lié à a T en GDP conduisant au retour du complexe a T -GDP. La concentration cytosolique de Ca 2+ joue également un rôle prépondérant. En effet, le Ca 2+ qui entre dans le segment externe a un effet négatif sur l'activité de la guanylate cyclase (2), enzyme qui permet la production de cGMP à partir de GTP et un effet positif sur l'activité de la PDE. Aussi en cas d'illumination, moins de Ca ++ entre dans la cellule du fait de la fermeture des canaux lumière-sensibles et donc l'activité de la gyanylate cyclase est moins inhibée ce qui entraîne une augmentation de la [cGMP]i et donc une réouverture des canaux cationiques. Enfin, il faut noter que R* s'inactive rapidement via (a) la rhodopsine kinase qui est activée par les sous-unités b T et g T et qui phosphoryle R* et ensuite via (b) une autre protéine appelée arrestine (ARRB1) qui reconnaît le site phosphorylé et prévient l'interaction avec la transducine (G T). Ainsi le phénomène de phototransduction s'atténue considérablement et des canaux lumière-sensibles peuvent s'ouvrir à nouveau.
(1) Chez les invertébrés, les photorécepteurs répondent à un flash lumineux par une dépolarisation.
(2) via une interaction avec la protéine guanylate cyclase activating
Pour plus d'information :
Rhodopsine : http://fr.wikipedia.org/wiki/Rhodopsine