Déphosphorylation et protéine phosphatases
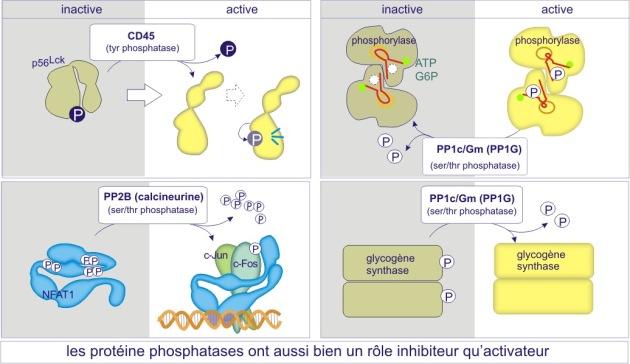
Si l'état phosphorylé des protéines est destiné à leur servir de système de régulation d'activité, les enzymes qui enlèvent les groupes phosphoryles (les phosphatases) sont aussi importantes que celles qui les apportent (les kinases ou phosphotransférases). Les phosphatases sont un composant obligé des systèmes de signalisation. Souvent elles sont physiquement liées à des kinases sous forme de complexes protéiques (voir figure 22B ci-dessous, ou la sous-unité régulatrice AKAP située sur le peroxysome, fixe à la fois la protéine kinase PKA et la phosphatase PP1c). Dans certains cas la déphosphorylation sert comme vrai bouton de « remise à zéro », ramenant l'activité protéique à un état de repos. Un bon exemple est donné par la sérine/thréonine phosphatase PP1G, qui convertit la phosphorylase a (active) en phosphorylase b (peu active), mettant ainsi un terme à la dégradation du glycogène (processus de glycogénolyse). A l'inverse, plusieurs facteurs de transcription (c-Jun, NFAT), l'enzyme glycogène synthase ou encore certaines tyrosine protéine kinases (Src, Lck), qui sont phosphorylés dans leur état de repos, ne deviennent actifs qu'après déphosphorylation de certains résidus (voir figure 20).
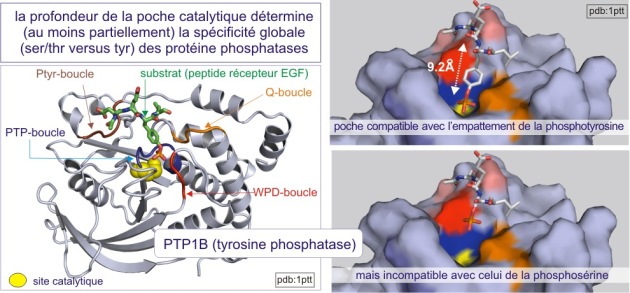
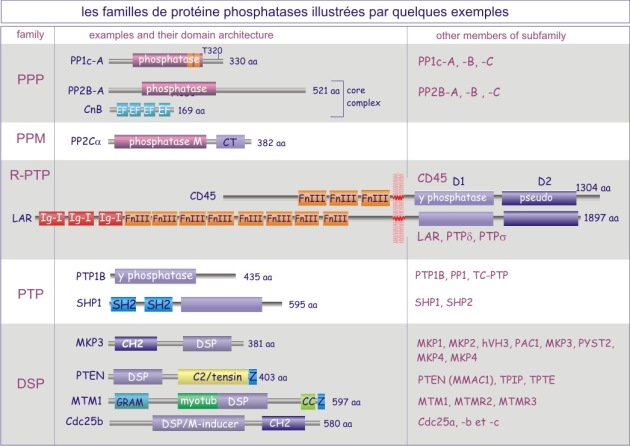
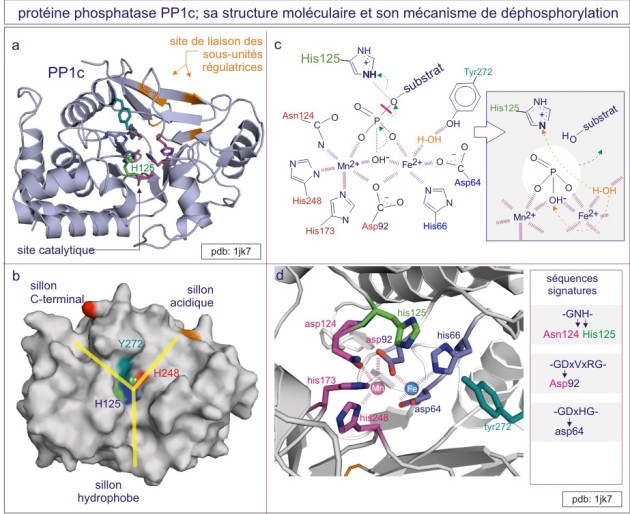
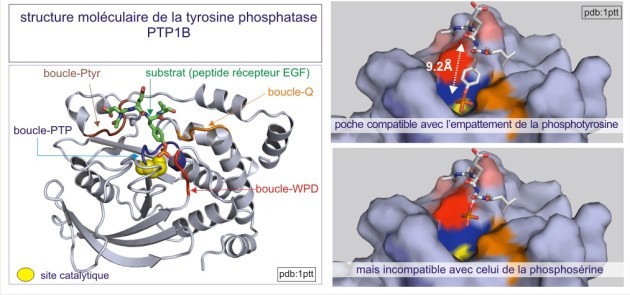
On distingue trois types de protéine phosphatases: sérine/thréonine (avec les sous-familles ‘PPP” et “PPM”), tyrosine (la sous-famille « PTP ») et phosphatases de double spécificité (classées sous l'acronyme DUS dans la sous-famille PTP). La base moléculaire de la spécificité vis-à-vis de la tyrosine ou au contraire de la sérine/thréonine, réside dans la dimension de la fente catalytique. Dans le cas des tyrosine phosphatases (les PTP), cette fente est profonde de 0,9 nm. L'acide aminé catalytique (cystéine nucléophile) se trouve au fond de la fente et ne peut être atteint que par la phospho-tyrosine. En effet la taille de sa boucle aromatique, qui porte le groupe phosphoryle, mesure 0,65 nm environ, alors que le site porteur de phosphoryle de la sérine ou de la thréonine ne mesure que 0,25 nm (voir figure 21 et rappelez vous que 9.2Å (Angstrom)= 0,92 nm (nanomètre)). Une autre distinction entre sérine/thréonine phosphatases d'une part et tyrosine phosphatases d'autre part porte sur la présence de deux ions métalliques (Fe2+ et Mn2+ ou Zn2+ Zn2+) dans le domaine catalytique.
Remarque : Quelques chiffres
Chez la levure (S. cerevisiae) les gènes codant l'unité catalytique des sérine/thréonine phosphatases (12 différentes) sont moins abondants que ceux des protéine kinases (116 différentes). Chez l'Homme les tyrosine phosphatases sont codées par 73 gènes alors que 90 gènes sont dédiés aux tyrosine kinases (à ce jour).
En général, les sous-unités catalytiques ou les domaines catalytiques des phosphatases ne confèrent qu'une très faible spécificité aux phosphatases. La spécificité plus fine est réalisée de deux façons :
a) dans le cas des tyrosine phosphatases (PTP), la spécificité semble être imposée non par une reconnaissance simple du substrat mais par une organisation spatiale, c'est-à-dire par adressage des phosphatases à des sites intracellulaires spéciaux (déterminé par un domaine régulateur intrinsèque). On peut illuster ce phénomène par l'exemple de la tyrosine phosphatase TC-PTP dont il existe deux variants d'épissage; la forme 48 kDa, portant un domaine hydrophobe C-terminal qui la dirige vers le réticulum endoplasmique rugueux (REr), alors que la forme 45 kDa se localise la plupart du temps dans le noyau (grâce au peptide de destination « noyau » bipartite).
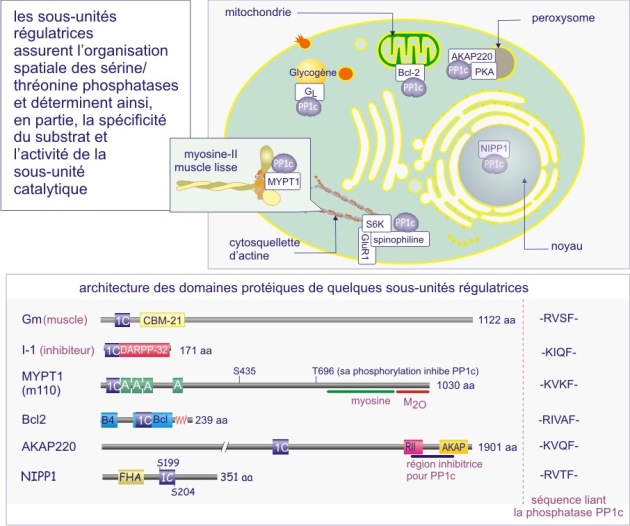
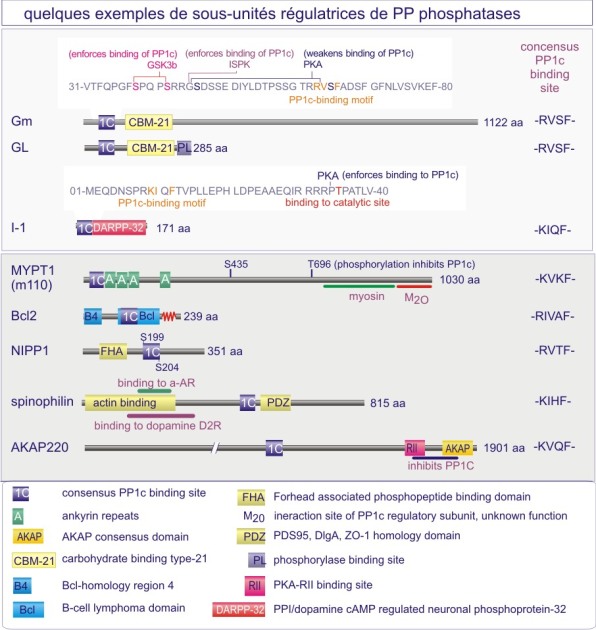
b) Dans le cas des sérine/thréonine phosphatases on trouve le même mécanisme mais déterminé cette fois par une sous-unité régulatrice (extrinsèque). Par exemple les sous-unités catalytiques des membres de la sous-famille PP1 (protein phosphatase-1) sont complexées à la myosine après leur liaison aux sous-unités régulatrices PPP1R1-2A ou -2B mais les sous-unités catalytiques ciblent le glycogène après leur liaison aux sous-unités régulatrices PPP1R-3A, -3B, 3C ou 3D. Il existe également un deuxième mécanisme à l'origine de la spécificité : empêchement « stérique » pour certains substrats par des sous-unités régulatrices (voir figures 22A et 22B).
Enfin, dans un but de régulation, les phosphatases peuvent aussi être phosphorylées dans leurs domaines ou sous-unités régulatrices. Cependant ce processus n'est pas indispensable pour rendre les phosphatases catalytiquement compétentes comme c'est le cas pour les protéines kinases.
Remarque : Les phosphatases: cibles de toxines et médicaments
Les sérine et thréonine phosphatases PP1 et PP2A sont les cibles de deux toxines naturelles :
1) l'acide okadaïque, produit par un dinoflagellé Dinophysis et qui s'accumule quelquefois dans les coquillages causant une diarrhée
2) la microcystine, produite par une algue bleue (Microcystis aeruginosa) causant des désordres hépatiques.
PP2B, aussi connu comme calcineurine, est la cible principale de la drogue immunosuppressive FK506 et de la cyclosporine, utilisées dans les traitements anti-rejet lors des transplantations d'organes.
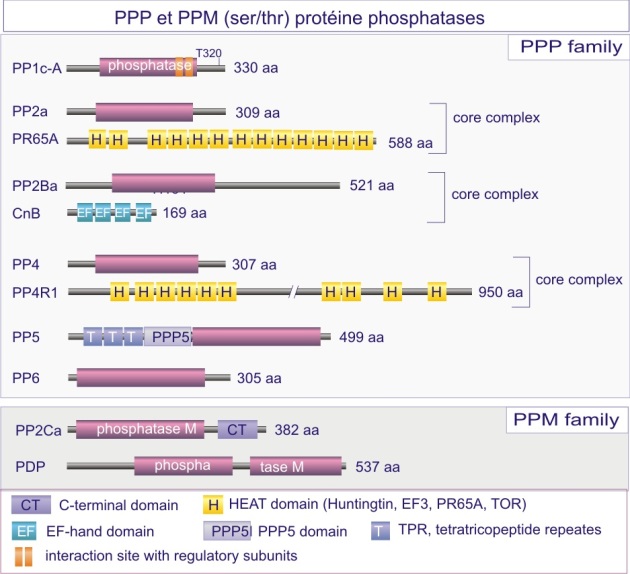
Complément : Excursion 8 : Détails de l'activité des phosphatases. Famille PPP (sérine/thréonine phosphatases).
a) FAMILLE PPP et PPM (sérine/thréonine phosphatases)
La majeure partie de l'activité sérine/thréonine phosphatase d'une cellule est due à PP1, PP2A, PP2B et PP2C. PP1 est impliquée dans le contrôle de multiples fonctions cellulaires telles que, métabolisme du glycogène, contraction musculaire, cycle de prolifération cellulaire et épissage de l'ARNm. Comme déjà mentionné dans le texte principal de cette ressource, ces différents processus sont régulés par des holoenzymes PP1 distinctes, dans lesquelles la même sous-unité catalytique est complexée à des sous-unités régulatrices variées. Pour donner un ordre de grandeur, sur les 100 protéines identifiées comme capables de se lier à PP1, 15 ont été reconnues à ce jour comme sous-unités régulatrices.
PP2B joue un rôle important dans la régulation de l'expansion clonale des lymphocytes-T sensibilisés à un antigène (présenté par des macrophages ou cellules dendritiques dans le contexte du complexe majeur d'histocompatibilité (CMH ou HLA chez l'Homme). PP2B est la sous-unité catalytique d'une holoenzyme appelée calcineurine, comprenant trois protéines : PP2B (connu aussi sous le nom de CnA), CnB (sous-unité régulatrice) et calmoduline. Son rôle est de déphosphoryler et activer le facteur de transcription NF-AT (nuclear factor of activated T-cells), qui par la suite entre dans le noyau pour y stimuler la transcription de l'interleukine-2 (Il-2), nécessaire à la multiplication des lymphocytes-T qui ont reconnu l'antigène (voir figures E17A et –B).
Les études cristallographiques de PP1 et PP2B apportèrent la première information convaincante sur le rôle d'ions métalliques, Fe 2+ et Mn 2+ ou Zn 2+ , dans la réaction catalytique (ce que n'est pas le cas des membres de la famille PTP , voir ci-dessous). Les acides aminés qui fixent les ions métalliques (asparate, histidine et asparagine) se retrouvent chez tous les membres de la famille PPP. Ces résidus, avec l'histidine, acide aminé catalytique, et l'arginine, donneur de proton (qui interagit avec la phospho-sérine ou –thréonine) sont tous conservés dans cinq motifs (supposés dériver d'une même métallophosphoestérase ancestrale). PP1 et PP2B partagent un domaine catalytique dont le repliement conduit à un beta-sandwich central flanqué d'un côté par 7 hélices-alpha et de l'autre côté par 3 hélices-alpha et un feuillet-beta à 3 brins. Un site catalytique peu profond est créé à l'interface du feuillet-beta à 3 brins. Les sérine/thréonine phosphatases catalysent la déphosphorylation en un temps, à l'aide d'une molécule d'H 2 O activée par un ion métallique et localisée à environ 0,2 nm de l'atome phosphore du groupe phosphoryle du substrat (dans le rayon van der Waals du phosphore) (voir figure E18).
Régulation de l'activité phosphatase
La région C-terminale des PPP est importante pour communiquer des signaux régulateurs au site catalytique. Un bon exemple est la phosphorylation de PP1, sur un résidu thréonine 320, par la protéine kinase Cdk2, causant ainsi son inhibition. Par conséquent, la protéine rétinoblastome (Rb) ne peut plus être déphosphorylée et sous l'influence de Cdk2 (parmi d'autres) s'accumule dans son état phosphorylé, ce qui permet l'entrée dans la phase synthèse (S) du cycle cellulaire. C'est un autre bon exemple d'une boucle de renforcement : Cdk2, protéine kinase qui dirige la progression dans le cycle cellulaire, exerce son effet stimulant à la fois par phosphorylation du Rb et par la phosphorylation inhibitrice de son « opposant », la phosphatase PP 1.
Famille PPM (sérine/thréonine phosphatases Mg 2+ /Mn 2+ -dépendantes)
PP2C, membre représentatif de cette sous-famille existe sous différentes isoformes telles que PP2C a et b , PDP et Wip1 ( PP2CD ) . Ces phosphatases furent à l'origine identifiées chez les Eucaryotes comme des phosphatases dépendantes de Mg2+ ou Mn2+ . Elles sont également présentes chez les Procaryotes, vraisemblablement à la suite d'un transfert génétique « horizontal ». Cette famille est présente dans des contextes structuraux variés qui reflètent sa diversité fonctionnelle.
Les séquences amino acidiques des protéines phosphatases de la famille PPM n'ont pas de similarités avec celles de la famille PPP , alors que la structure tertiaire des membres de ces deux familles est remarquablement similaire. La PP2C mammalienne possède deux domaines : d'une part, un domaine catalytique N-terminal, fait de 6 hélices-alpha entourant 11 brins-beta, bien préservé dans les différentes espèces, et d'autre part, un domaine C-terminal de 90-résidus agencés en 3 hélices-alpha. Ce domaine représente une constante des PP2C mammaliennes. Au site catalytique, deux ions Mn2+ (d'où le nom PP M ) sont hébergés par quartes résidus aspartate, un glutamate et six molécules d'eau. La déphosphorylation se déroule comme décrit pour les PPP.
b) FAMILLE PTP (tyrosine phosphatases)
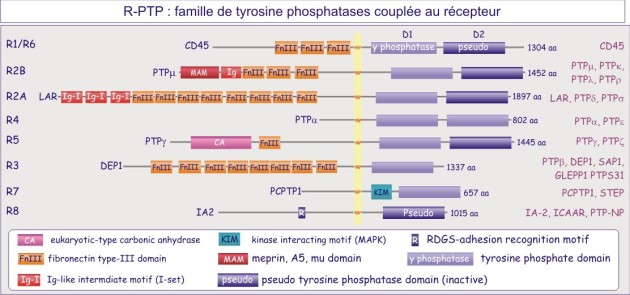
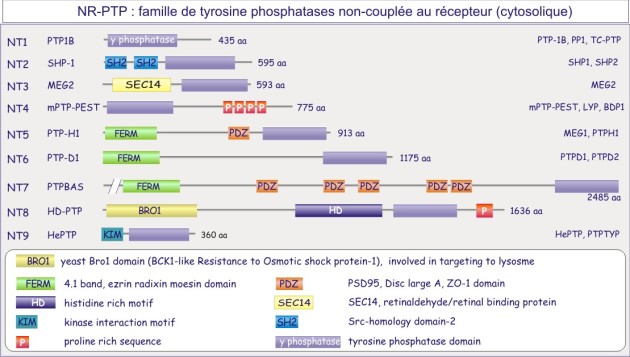
On distinct deux grandes familles de tyrosine phosphatases, celle représenté par des protéines transmembranaire portant une activité phosphatase, les récepteur-tyrosine phosphatases (figure E19A) et la famille non-couplée au récepteur (cytosolique) (figure E19B).
PTP1B , protéine cytosolique de 50 kDa, fut la première tyrosine phosphatase purifiée et analysée. Sa séquence est similaire à celle du domaine intracellulaire de CD45, protéine transmembranaire importante dans l'expansion clonale des lymphocytes-T. Nous connaissons maintenant une famille entière de tyrosine phosphatases dont certaines à localisation membranaire (récepteurs) et d'autres à localisation cytosolique.
Le domaine catalytique de PTP1B (protéine de 37 kDa) fut le premier à être analysé en détail en 1994. Sa structure révèle un seul domaine organisé en 8 hélices-alpha et 12 brins-beta, dont 10 forment un feuillet-beta mixte qui adopte une conformation vrillée sur toute la longueur de la protéine. L'architecture de la fente catalytique est caractérisée par : 1) un résidu catalytique cystéine au fond (Cys215) et 2) trois structures qui forment les parois de la fente. Il s'agit de :Le domaine catalytique de PTP1B (protéine de 37 kDa) fut le premier à être analysé en détail en 1994. Sa structure révèle un seul domaine organisé en 8 hélices-alpha et 12 brins-beta, dont 10 forment un feuillet-beta mixte qui adopte une conformation vrillée sur toute la longueur de la protéine. L'architecture de la fente catalytique est caractérisée par : 1) un résidu catalytique cystéine au fond (Cys215) et 2) trois structures qui forment les parois de la fente.
Il s'agit de :
a) la boucle WPD (avec l'important résidu Asp181),
b) la boucle Q (avec l'important résidu Glu262) et
c) la boucle pTyr (avec l'important Tyr46, qui positionne correctement la phosphotyrosine (du substrat) dans la fente).
L'insertion de la phosphotyrosine du substrat cause un changement conformationnel de la boucle WPD , positionnant ainsi l'Asp181 près du résidu catalytique Cys215 (voir figure E20). Ceci est un bon exemple de convenance induite (« induced fit »), par laquelle la liaison du substrat induit un changement conformationnel qui donne naissance à une enzyme catalytiquement compétente.
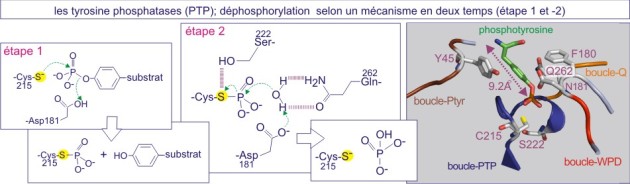
La déphosphorylation catalysée par la tyrosine phosphatase se fait selon un mécanisme à deux temps (voir figure E21). Le premier temps consiste en une attaque nucléophilique sur le phosphore de la phosphotyrosine par un atome de soufre (S) appartenant à la chaîne latérale de la cystéine catalytique (Cys215 dans PTP1B). Cette cystéine se trouve dans une séquence amino acidique très conservée, -[I/V]HCxxGxxR[S/T]-, constituant le motif de signature des tyrosine phosphatases (en d'autres termes, les protéines porteuses de cette séquence sont systématiquement qualifiées de tyrosine phosphatases (PTP)). L'attaque nucléophilique est couplée à la protonation du groupe tyrosyl partant (substrat), par la chaîne latérale de l'asparagine 181, qui se comporte comme un acide général (donneur de proton ou H+). Ceci conduit à la formation d'un intermédiaire cystéinyl-phosphate. Le second temps consiste en l'hydrolyse du groupe phosphoryl, réaction rendue possible par la glutamine 262, qui fonctionne comme une base générale (accepteur de proton).
Les phosphatases à double spécificité
Il existe également des phosphatases à double spécificité, qui déphosphorylent les phosphoserines/phosphothréonines ainsi que les phosphotyrosines.
pour voir les membres de la famille de phosphatases à double spécificité (DSP).
![]() Pour en savoir plus :
Pour en savoir plus :
« PDF Tonks PTP1B purification [pdf] » (274 Ko).
« PDF Zhang, streptomyces, PPM, microbiology 2004 [pdf] » (399 Ko).
« PDF 16 PPase ann review Barford [pdf] » (718 ko).